题目内容
(9分)氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
⑴①该反应的熵变△S 0(填“>”、“<”或“=”)。
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H 0(填“>”、“<”或“=”)。
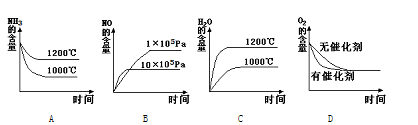
⑵若其他条件不变,下列关系图错误的是 (选填序号)。
⑶在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
①反应在第 2 min 到第 4 min 时,反应速率υ(O2) = ;
②反应在第 2 min 时改变了条件,改变的条件可能是 。
该条件下,反应的平衡常数K= (只写计算结果,不标单位)。
 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g) ⑴①该反应的熵变△S 0(填“>”、“<”或“=”)。
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H 0(填“>”、“<”或“=”)。
⑵若其他条件不变,下列关系图错误的是 (选填序号)。

⑶在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第 2 min | 3.2 | | 0.8 | 1.2 |
| 第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
②反应在第 2 min 时改变了条件,改变的条件可能是 。
该条件下,反应的平衡常数K= (只写计算结果,不标单位)。
(9分)⑴ ① > (1分)。 ② <(1分)。 ⑵ C (2分。填错或多填0分。)。
⑶ ①0.75 mol·L-1·min-1(2分。没写单位扣1分。)
②升高温度(或使用催化剂)(1分。两种条件都填也可);
3.0mol/L(2分。有效数字错误或单位错误、没写单位扣1分。)
⑶ ①0.75 mol·L-1·min-1(2分。没写单位扣1分。)
②升高温度(或使用催化剂)(1分。两种条件都填也可);
3.0mol/L(2分。有效数字错误或单位错误、没写单位扣1分。)
略

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
xC(g) + 2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol·Lˉ1,下列叙述中不正确的是 ( )
 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。 Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。 NH3·H2O
NH3·H2O 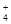 +OH-
+OH-