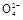题目内容
下列有关金属的工业制法中,正确的是( )
| A.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
| B.制铝:工业上电解氯化铝来制备铝 |
| C.制钠:电解饱和NaCl溶液 |
| D.炼铁:用CO在高温下还原铁矿石中的铁 |
D
解析试题分析:A选项错误,用黄铜矿(主要成分为CuFeS2)直接得到的是粗铜。 B选项错误,工业电解氧化铝来制备铝。C选项错误,工业是电解熔融的NaCl来制备Na 。D选项正确。工业高炉炼铁原理是CO和氧化铁在高温下反应。
考 点:要求学生掌握一定的金属冶炼的基本知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)  2Na+Cl2↑ 2Na+Cl2↑ | B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO  3Fe+4CO2 3Fe+4CO2 | D.2HgO 2Hg + O2↑ 2Hg + O2↑ |
对下列过程中发生反应的叙述正确的是
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程所涉及的反应均为置换反应 |
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铁;(Ⅳ)从氯化镁中炼镁,对它们的冶炼方法的分析不正确的是( )
| A.(I)用① | B.(Ⅱ)用② | C.(Ⅲ)用③ | D.(Ⅳ)用④ |
下列有关说法正确的是
| A.高温加热氧化镁和碳的混合物可以制单质镁 |
| B.铁的冶炼过程是通过置换反应得到单质铁 |
| C.海水提溴的过程中不发生氧化还原反应 |
| D.利用电解的方法可以从海水中获得淡水 |
Ⅰ下列说法不正确的是____ 。
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
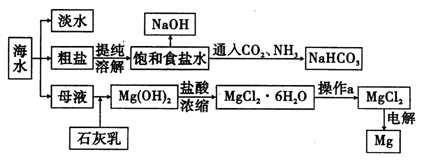
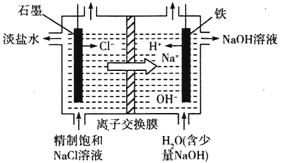
请回答下列问题:
(1)用离子交换膜电解饱和食盐水时,精制的饱和食盐水应该加入到 极室。
(2)已知在离子交换膜电解槽中,理论上每小时通过1安培的直流电,每槽可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342×103 kg/m3)113 m3,电解槽的电流强度1.45×l04 A,该电解槽的电解效率为 。
(3)示意图中制取NaHC03的化学方程式为 。
(4)有人提出直接加热Mg(OH)2得到Mg0,再电解熔融Mg0得金属Mg,这样可简化流程。请判断该方案是否可行,并说明理由 。
世界上60%的镁是从海水中提取的,其主要步骤如下:①把贝壳制成石灰乳 ②在海水中加入石灰乳,过滤,洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤 ④在氯化氢热气流中干燥晶体 ⑤电解上述晶体的熔融物。下列说法不正确的是 ( )。
| A.镁元素在元素周期表中位于第3周期,ⅡA族 |
| B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| C.在氯化氢热气流中干燥晶体的目的是抑制MgCl2水解 |
| D.步骤⑤也可以采用电解该晶体水溶液的方法 |
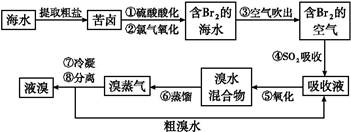
 2H++2Br-+S
2H++2Br-+S