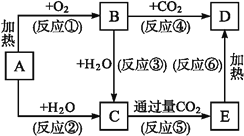
题目内容
【题目】已知:![]() ,
,![]() 。常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液的
。常温下,向某浓度的盐酸溶液中滴加氢氧化钠溶液,所得溶液的![]() 和
和![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
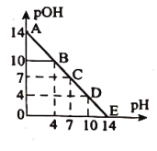
A.盐酸与![]() 溶液的浓度相等
溶液的浓度相等
B.![]() 点和
点和![]() 点水的电离程度相同
点水的电离程度相同
C.滴加![]() 溶液改为加水稀释,该图曲线不变
溶液改为加水稀释,该图曲线不变
D.升高温度,滴定过程中pH+pOH>14
【答案】B
【解析】
A.根据图象看,初始时盐酸的pH=0,则盐酸的浓度为1mo/L,但无法判断NaOH溶液的浓度,故A错误;
B.B点溶液呈酸性,pH=4,氢氧根离子来自水的电离,pOH=10,则c(OH-)=10-10mol/L;D点溶液呈碱性,pH=10,溶液中氢离子来自水的电离,由pH=10,则水电离出的c(H+)=10-10mol/L,由水电离出的c(OH-)=10-10mol/L,所以B、D两点水的电离程度相同,故B正确;
C.滴加NaOH溶液改为加水稀释,盐酸溶液中氢离子浓度逐渐减小,最终只能接近10-7mol/L,溶液的pH只能无限接近7,不可能大于7,与图象变化不符,故C错误;
D.常温下pOH+pH=14,升高温度后水的电离程度增大,则pOH+pH<14,故D错误;
答案为B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】短周期元素A,B,C在周期表中所处的位置如图所示。A,B,C三种元素原子的质子数之和为37,D元素原子的最外层电子数为次外层电子数的3倍。则下列说法正确的是
B | ||
A | C |
A.元素C形成的一种氧化物具有漂白性能使品红溶液和石蕊试液褪色
B.B,C两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在高温下,元素A的氧化物可与它同主族的单质反应制取A的单质并生成![]()
D.四种元素形成的气态氢化物中,D元素形成的氢化物的稳定性最强,沸点也最高
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)工业上利用甲酸的能量关系转换图如图:

反应![]() 的焓变
的焓变![]() ________
________![]() 。
。
(2)某科学小组研究不同压强条件对反应![]() 的影响。
的影响。![]() 下,在一个容积可变的密闭容器中,充入一定量的
下,在一个容积可变的密闭容器中,充入一定量的![]() 和
和![]() ,测得不同压强下,平衡时容器内气体的浓度如下表:
,测得不同压强下,平衡时容器内气体的浓度如下表:
试验编号 | 反应压强 | 物质浓度 | ||
|
|
| ||
1 |
| 0.3 | 0.3 | 0.9 |
2 |
|
|
| 0.4 |
3 |
| 0.4 | 0.4 |
|
试回答以下问题:
①平衡时,实验1的正反应速率________(填“>”、“<”或“=”)实验3的逆反应速率。
②由实验1的数据可计算![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
③![]() ________
________![]() 。
。
(3)经研究发现采用电还原法也可将![]() 转化为甲酸根,同时还能提高
转化为甲酸根,同时还能提高![]() 的转换效率。其电解原理如图所示,下列叙述正确的是________。
的转换效率。其电解原理如图所示,下列叙述正确的是________。
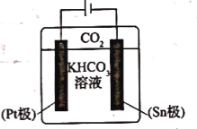
A.![]() 极的电极反应式为
极的电极反应式为![]()
B.电解过程中![]() 向
向![]() 极移动
极移动
C.![]() 极发生还原反应并有气体逸出
极发生还原反应并有气体逸出
D.电解过程中![]() 浓度逐渐减小
浓度逐渐减小
(4)甲酸的用途之一是用于配制“缓冲溶液”,在这种溶液中加入少量的强酸蚀碱,溶液的![]() 变化不大,能保持溶液
变化不大,能保持溶液![]() 相对稳定。(已知甲酸的电离平衡常数
相对稳定。(已知甲酸的电离平衡常数![]() )
)
①现将等浓度甲酸与甲酸钠溶液混合,配成![]() 的
的![]() 缓冲溶液。用离子方程式表示将少量强碱加入
缓冲溶液。用离子方程式表示将少量强碱加入![]() 缓冲溶液中,
缓冲溶液中,![]() 变化不大的原因是________。
变化不大的原因是________。
②若用![]() 溶液配制
溶液配制![]() 为4的缓冲溶液,需加入________
为4的缓冲溶液,需加入________![]() (答案保留一位小数)
(答案保留一位小数)![]() 溶液。
溶液。