题目内容
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为ABC三套实验装置。
A、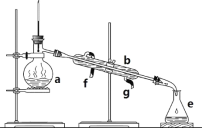 B、
B、 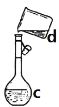 C、
C、 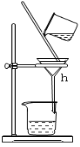
(1)写出下列仪器的名称:b.___, c._____,h.____。
(2)仪器a~e中,使用前必须检查是否漏水的有_____。(填序号)
(3)若利用装置分离酒精和水的混合物,还缺少的仪器是_____,将仪器补充完整后进行实验,冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,B装置是某同学转移溶液的示意图。
① B 图中的错误是_____。
② 根据计算得知,所需NaOH的质量为_______。
③ 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作_______;容量瓶用蒸馏洗涤后残留有少量的水_________;若定容时俯视刻度线_______。
(6)将(4)所配溶液滴入盛有硫酸铜溶液试管中,可以观察到现象是_____,发生反应的离子方程式为_______,若将得到混合物进行分离,可选用分离方法是_________。
【答案】直形冷凝管 容量瓶 漏斗 c 酒精灯 f 未用玻璃棒引流 2.0g BCAEFD 偏低 无影响 偏高 产生蓝色沉淀 Cu2++2OH- = Cu(OH)2↓ 过滤
【解析】
(1)a、b、c、d、h分别指的是圆底烧瓶、直形冷凝管、容量瓶、烧杯、漏斗;
(2)仪器a~e中,使用前必须检查是否漏水的是c(容量瓶),如果容量瓶漏水,在定容后摇匀会有液体流出,这种情况下如果液体没有摇匀,会造成溶剂减少或溶质减少,导致配制的溶液的浓度偏大或偏小,所以要检查容量瓶是否漏水,若漏水,则需要更换;
(3)水和酒精互溶,分离水和酒精的混合物用蒸馏法,还缺少的仪器是酒精灯,冷凝水应下进上出,所以水由g口通入,f口流出;
(4)①转移溶液要用玻璃棒引流,图中的错误是未用玻璃棒引流;
②配制0.1mol/LNaOH溶液450mL,但是没有量程为450mL的容量瓶,所以选用500mL的容量瓶,根据计算得知,NaOH的质量为:0.1mol/L×0.5L×40g/mol=2.0g;
③配制时,其正确的操作顺序是:
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
D.将容量瓶盖紧,振荡,摇匀
(5)若没有进行A操作,部分溶质残留在烧杯壁上,则溶液中溶质质量偏小,根据c=n/V可知,所配制的溶液浓度偏低;容量瓶用蒸馏水洗涤后残留有少量的水对所配溶液无影响,因为配制过程中也需要加入蒸馏水;若定容时俯视刻度线,导致实际体积<容量瓶的量程,根据c=n/V可知,所以所配溶液浓度偏高;
(6)将(4)所配溶液滴入盛有硫酸铜溶液试管中,可以观察到现象是产生蓝色沉淀,发生反应的离子方程式为Cu2++2OH- = Cu(OH)2↓,若将得到混合物进行分离,过滤即可。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) ![]() N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度