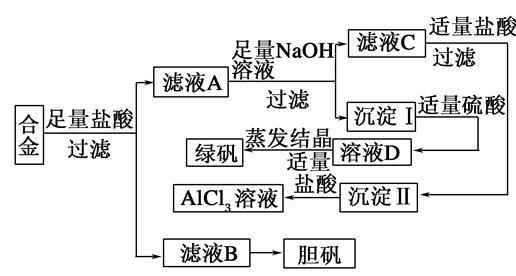
题目内容
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
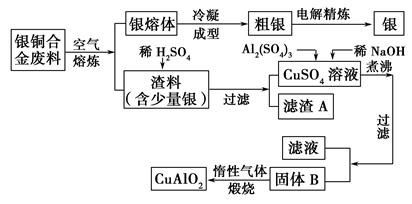
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:
CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:
CuO+____Al2O3
 ____CuAlO2+________↑。
____CuAlO2+________↑。(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
(1)Ag++e-=Ag 2NO+O2=2NO2
(2)Al(OH)3、Cu(OH)2 Al(OH)3+OH-=AlO2—+2H2O
(3)4 2 4 O2
(4)50 25
(5)蒸发浓缩、冷却结晶
(2)Al(OH)3、Cu(OH)2 Al(OH)3+OH-=AlO2—+2H2O
(3)4 2 4 O2
(4)50 25
(5)蒸发浓缩、冷却结晶
(1)电解精炼Ag时,粗银作阳极,纯银作阴极,含有Ag+的电解质溶液作为电解液,所以阴极反应式为Ag++e-=Ag,滤渣Ag与稀HNO3反应生成NO,NO被O2氧化生成NO2,方程式为2NO+O2=2NO2。
(2)NaOH溶液与Al2(SO4)3、CuSO4反应生成Al(OH)3沉淀和Cu(OH)2沉淀,若NaOH过量,Al(OH)3沉淀溶解,离子方程式为Al(OH)3+OH-=AlO2—+2H2O。
(3)由于在反应前后,Cu的化合价降低,CuO作氧化剂,所以失电子的只能是O2-,被氧化成O2,利用得失电子守恒配平。
(4)4Cu~4CuO~2Al2O3~2Al2(SO4)3~4CuAlO2
即2Cu~Al2(SO4)3~2CuAlO2
n(Cu)=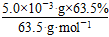 =50 mol
=50 mol
所以可完全转化生成50 mol CuAlO2,
至少需要Al2(SO4)3的体积为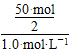 =25.0 L。
=25.0 L。
(5)由于胆矾带有结晶水,为防止失去结晶水,应采取加热浓缩、冷却结晶的方法。
(2)NaOH溶液与Al2(SO4)3、CuSO4反应生成Al(OH)3沉淀和Cu(OH)2沉淀,若NaOH过量,Al(OH)3沉淀溶解,离子方程式为Al(OH)3+OH-=AlO2—+2H2O。
(3)由于在反应前后,Cu的化合价降低,CuO作氧化剂,所以失电子的只能是O2-,被氧化成O2,利用得失电子守恒配平。
(4)4Cu~4CuO~2Al2O3~2Al2(SO4)3~4CuAlO2
即2Cu~Al2(SO4)3~2CuAlO2
n(Cu)=
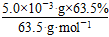 =50 mol
=50 mol所以可完全转化生成50 mol CuAlO2,
至少需要Al2(SO4)3的体积为
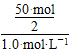 =25.0 L。
=25.0 L。(5)由于胆矾带有结晶水,为防止失去结晶水,应采取加热浓缩、冷却结晶的方法。

练习册系列答案
相关题目

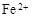 和
和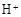 外,还可能存在 (用离子符号表示),检测该离子的方法是 。
外,还可能存在 (用离子符号表示),检测该离子的方法是 。