题目内容
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液进行处理。
(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____。
(3)该小组同学向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是 。
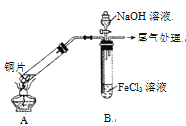
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-。则Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____。(忽略过程中溶液的体积变化)
【答案】(1)气密性; NaOH;(2)100 mL容量瓶、胶头滴管;抑制FeCl3水解;(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;先无现象,后生成白色絮状沉淀;(4)Fe(HSO3)2++Fe3++H2O=2Fe2++SO42-+3H+;(5)18 mo1·L-1.
【解析】
试题分析:(1)实验前,应先检查装置的气密性;实验中产生的尾气是SO2,应通入NaOH溶液进行处理;(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,配制一定物质的量浓度的溶液需要的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、定容时还要用到胶头滴管,配制过程中,由于Fe3+容易发生水解,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,抑制Fe3+的水解,答案为:100 mL容量瓶、胶头滴管;抑制FeCl3水解;(3)向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,生成了Fe2+,SO2被氧化为H2SO4,发生的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,试管中有硫酸和硫酸亚铁,加入稀NaOH溶液,先和硫酸发生中和反应,这一阶段无明显现象,当硫酸反应完后,将和硫酸亚铁反应生成氢氧化亚铁,由于氢氧化钠是煮沸除去了氧气的,所以氢氧化亚铁不会被氧化为氢氧化铁,答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;先无现象,后生成白色絮状沉淀;(4)Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-,则Fe3+被还原为Fe2+,反应的离子方程式为:Fe(HSO3)2++Fe3++H2O=2Fe2++SO42-+3H+;(5)5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,Cu+2H2SO4=CuSO4+SO2↑+2H2O,n(SO2)=0.672L/22.4L/mol=0.03mol, 算出n(CuSO4)=0.03mol,n1(H2SO4)=0.06mol, 向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀,Cu不会和稀硫酸反应,A中还有稀硫酸,当加入NaOH溶液时,首先和未反应的硫酸反应,硫酸反应完后再和CuSO4反应,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
n1 (NaOH)=2n(CuSO4)=0.06mol,和硫酸反应的氢氧化钠的物质的量为n2(NaOH)=4mol·L-1×0.03L-0.06mol=0.06mol,n2(H2SO4)=0.06mol/2=0.03mol,总硫酸的物质的量为0.03mol+0.06mol=0.09mol,c(H2SO4)=0.09mol/0.005L=18mol/L,答案为:18mol/L.

 优等生题库系列答案
优等生题库系列答案