题目内容
【题目】某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )
A. Cl- B. SO42- C. OH- D. Na+
【答案】A
【解析】Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,根据电荷守恒可得,2n(Mg2+)+n(K+)>n(NO3-),阴离子电荷少,所以M离子应带有负电荷,根据电荷守恒可知M带一个负电荷,而OH-与Mg2+反应生成氢氧化镁沉淀,不能大量共存,所以M离子可能是氯离子,答案选A。

练习册系列答案
相关题目
【题目】某科研小组取用0.2 L营养液进行实验。该营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度如下表所示。
离子符号 | K+ | SO | Cl- |
物质的量浓度(mol·L-1) | 9.0 | 4.0 | 9.0 |
(1)该营养液中K2SO4的物质的量浓度为________,含溶质KCl的质量为________。
(2)该营养液中NH4Cl的物质的量为________。
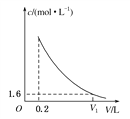
(3)该营养液加水稀释的过程中测得溶液中NH![]() 的物质的量浓度(c)随溶液体积(V)变化的曲线如图所示,则V1为________L。此时营养液中KCl的物质的量浓度为________。
的物质的量浓度(c)随溶液体积(V)变化的曲线如图所示,则V1为________L。此时营养液中KCl的物质的量浓度为________。