题目内容
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
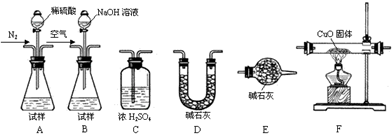
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)
(1)②AlN+NaOH+H2O NaAlO2+NH3↑
NaAlO2+NH3↑
(3)②K2、K3 K1 稀硫酸 ③K1 K3 NaOH ④打开K2,通入空气一段时间
(4)① ×100% ②偏小 ③
×100% ②偏小 ③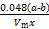 ×100%
×100%
【解析】(3)A装置是测量CH4的装置、D装置是吸收NH3的装置,从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3、AlN完全反应,生成甲烷、铵盐,量取生成的甲烷,从而可测得Al4C3的质量分数;用足量NaOH溶液与生成的铵盐反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;③Al4C3的物质的量等于甲烷的物质的量的,可求得Al4C3的质量分数


 (AlN)制备:Al2O3+N2+3C
(AlN)制备:Al2O3+N2+3C 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为 。
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为 。 CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下:
CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下: