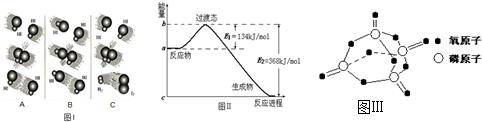
题目内容
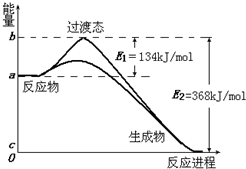
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。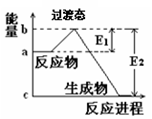
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:
NO2+CO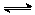 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
(8分)(1)放热(1分)、>(1分)、0.05mol/(L·min)(2分)、1.5mol(2分)、BD(2分)
解析试题分析:(1)根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,因此NO2和CO的总能量>CO2和NO的总能量。
(2)①容器中NO的物质的量为0.2 mol,则根据方程式可知,生成CO2的物质的量也是0.2mol,所以该段时间内,用CO2表示的平均反应速为 0.05mol/(L·min)。
0.05mol/(L·min)。
根据化学方程式可知,反应前后气体的体积是不变的,所以反应后气体的总的物质的量仍然是0.5mol+1mol=1.5mol。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确;根据质量守恒定律可知,容器内气体的质量是不变的,所以A不正确;根据方程式可知,反应前后气体的体积是不变的,所以容器内气体的物质的量保持不变,则E不能说明;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,在反应过程中质量和气体的物质的量是不变的,C不能说明;D中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,所以正确的答案选BD。
考点:考查反应热的判断、反应速率的计算以及平衡状态的判断等
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。

 名校课堂系列答案
名校课堂系列答案
图Ⅰ
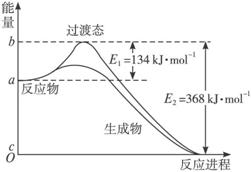
图Ⅱ
(1)图Ⅰ是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是_______(选填“A”“B”或“C”)。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图。
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 197 | 360 | 499 | X |

图Ⅲ
已知白磷的燃烧热为2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X=_________。