题目内容
有关说法错误的是( )
| A、除去镁粉中的铝粉可选用烧碱 |
| B、等质量Al分别与足量浓硫酸和足量浓NaOH溶液放出等量的H2 |
| C、铝分别与足量稀盐酸和NaOH溶液反应,当两个反应放出的气体体积相同时,消耗的HCl和NaOH物质的量比为3:1 |
| D、等质量的两份铝分别和等物质的量的H2SO4与NaOH反应,若生成氢气质量比为7:8,则可推断必定是酸中的铝过量,而碱过量 |
考点:铝的化学性质
专题:几种重要的金属及其化合物
分析:A.铝和氢氧化钠反应,而Mg不能;
B.浓硫酸有强氧化性;
C.稀盐酸、氢氧化钠足量,则生成等量气体、酸、碱物质的量不同;
D.生成氢气质量比为7:8,在1:3~1:1之间,则酸不知,碱过量,以此计算.
B.浓硫酸有强氧化性;
C.稀盐酸、氢氧化钠足量,则生成等量气体、酸、碱物质的量不同;
D.生成氢气质量比为7:8,在1:3~1:1之间,则酸不知,碱过量,以此计算.
解答:
解:A.铝和氢氧化钠反应会生成偏铝酸钠和氢气,而Mg不反应,则溶解后过滤可除去镁粉中的铝粉,所以除杂试剂可选用烧碱,故A正确;
B.浓硫酸有强氧化性,铝和浓硫酸接触生成二氧化硫,且会生成致密的氧化铝薄膜,阻碍了反应的继续进行,所以等质量Al分别与足量浓硫酸和足量浓NaOH溶液不会放出等量的H2,故B错误;
C.由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,足量稀盐酸和NaOH溶液,则Al完全反应,放出的气体体积相同时,消耗的HCl和NaOH物质的量比为3:1,故C正确;
D.由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,等量的Al与足量酸、碱生成氢气为1:1,足量的Al与等量的酸碱反应,生成氢气为1:3,则通过方程式可以看出,生成氢气质量比为7:8,在1:3~1:1之间,则酸不知,碱过量,即等质量的两份铝分别和等物质的量的H2SO4与NaOH反应,所以必定是酸中的铝过量,而碱过量,故D正确.
故选B.
B.浓硫酸有强氧化性,铝和浓硫酸接触生成二氧化硫,且会生成致密的氧化铝薄膜,阻碍了反应的继续进行,所以等质量Al分别与足量浓硫酸和足量浓NaOH溶液不会放出等量的H2,故B错误;
C.由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,足量稀盐酸和NaOH溶液,则Al完全反应,放出的气体体积相同时,消耗的HCl和NaOH物质的量比为3:1,故C正确;
D.由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,等量的Al与足量酸、碱生成氢气为1:1,足量的Al与等量的酸碱反应,生成氢气为1:3,则通过方程式可以看出,生成氢气质量比为7:8,在1:3~1:1之间,则酸不知,碱过量,即等质量的两份铝分别和等物质的量的H2SO4与NaOH反应,所以必定是酸中的铝过量,而碱过量,故D正确.
故选B.
点评:本题考查Al的化学性质,为高频考点,把握Al的特性及发生的反应为解答的关键,侧重分析与知识应用能力的考查,选项D为解答的难点,题目难度中等.

练习册系列答案
相关题目
把铁放入下列溶液中,铁溶解而溶液质量减轻的是( )
| A、氯化铁溶液 |
| B、稀硫酸 |
| C、热的氢氧化钠溶液 |
| D、硫酸铜溶液 |
下列实验,不能达到实验目的是( )
| A、用蒸馏方法可以分离乙醇(沸点78.4℃)和二甲醚(沸点24.9℃)的混合物 |
| B、用加热分解的方法,区分碳酸钠和碳酸氢钠两种固体 |
| C、用加热蒸干氯化铜溶液的方法制备无水氯化铜 |
| D、用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体 |
下列各组物质能一起混合施用的是( )
| A、铵态氮肥和草木灰(含K2CO3)混合施用 |
| B、化肥和农家肥(如绿肥)混合施用 |
| C、重钙施入碱性土壤中 |
| D、复合肥(如磷酸氢二铵)和生石灰一起施用 |
下列分子中所有原子都处于同一平面上的是( )
| A、乙烷、丙烯、丙炔 |
| B、乙烯、乙炔、苯 |
| C、1,3-丁二烯、甲苯、环乙烷 |
| D、丙烯、乙炔、乙烷 |
有两种不同的原子团-X、-Y,若同时分别取代甲苯苯环上的两个氢原子,生成的同分异体的数目是( )
| A、10种 | B、9种 | C、6种 | D、4种 |
下列物质中,属于酚类的是( )
A、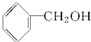 |
B、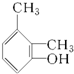 |
C、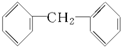 |
D、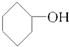 |
 为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置.下列判断合理的是( )
为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置.下列判断合理的是( )| A、左边铜片上有气泡冒出 |
| B、右边锌片上的反应为2Cl--2e-=Cl2↑ |
| C、最先观察到红色的区城是② |
| D、左右两边Cu片质量均不发生变化 |