题目内容
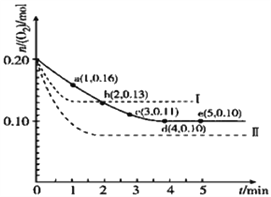
【题目】一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
(1)该温度下反应的平衡常数K为_______________(不用带单位),升高温度K值将_______________(填增大、不变或减小,下同)。
(2)若温度不变,在容器中再加1mol O2,重新达到平衡,则SO2的平衡浓度将_______________,氧气的转化率将_______________,SO3的体积分数将_______________。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线Ⅰ改变的实验条件是_______________,曲线Ⅱ改变的实验条件是_______________。
【答案】 20 减小 减小 减小 减小 升高温度 增大压强
【解析】试题分析:(1)由题意和图中实线可知,SO2、O2的起始浓度分别为0.2mol/L、0.1mol/L,O2的平衡浓度分别为0.05mol/L,由2 SO2(g)+O2(g)![]() 2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为0.1mol/L、0.05mol/L、0.1mol/L,该温度下反应的平衡常数K =
2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为0.1mol/L、0.05mol/L、0.1mol/L,该温度下反应的平衡常数K =![]() =
=![]() =" 20" Lmol-1;2 SO2(g)+O2(g)
=" 20" Lmol-1;2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是ΔH < 0的放热反应,升温导致平衡向吸热方向或逆反应方向移动,则平衡常数K减小;(2)若温度不变,在容器中再加1 mol O2,增大氧气浓度,平衡向正反应方向移动,则重新达到平衡,则SO2的平衡浓度将减小;氧气的转化率将减小,虽然其变化浓度增大,但c(O2)起始与c(O2)加入之和增大的程度更大,由
2 SO3(g)的正反应是ΔH < 0的放热反应,升温导致平衡向吸热方向或逆反应方向移动,则平衡常数K减小;(2)若温度不变,在容器中再加1 mol O2,增大氧气浓度,平衡向正反应方向移动,则重新达到平衡,则SO2的平衡浓度将减小;氧气的转化率将减小,虽然其变化浓度增大,但c(O2)起始与c(O2)加入之和增大的程度更大,由![]() 可知,氧气的平衡转化率降低;原平衡时,SO3的体积分数=
可知,氧气的平衡转化率降低;原平衡时,SO3的体积分数=![]() =40%;若温度不变,在容器中再加1 mol O2,平衡右移,设氧气的变化浓度为xmol/L,重新达到平衡时,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的体积分数=
=40%;若温度不变,在容器中再加1 mol O2,平衡右移,设氧气的变化浓度为xmol/L,重新达到平衡时,SO2(g)、O2(g)、SO3(g)的平衡浓度分别为(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的体积分数=![]() ,由于正反应不能进行到底,则SO3的体积分数介于
,由于正反应不能进行到底,则SO3的体积分数介于![]() =11.8%和
=11.8%和![]() =25%之间,则SO3的体积分数比原平衡时减小;(3)从实线到虚线中的曲线I,达到平衡的时间缩短且氧气的平衡浓度增大,说明平衡向逆反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)
=25%之间,则SO3的体积分数比原平衡时减小;(3)从实线到虚线中的曲线I,达到平衡的时间缩短且氧气的平衡浓度增大,说明平衡向逆反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是ΔH < 0的放热反应,因此采取的措施是升高温度;从实线到虚线中的曲线II,达到平衡的时间缩短且氧气的平衡浓度减小,说明平衡向正反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)
2 SO3(g)的正反应是ΔH < 0的放热反应,因此采取的措施是升高温度;从实线到虚线中的曲线II,达到平衡的时间缩短且氧气的平衡浓度减小,说明平衡向正反应方向移动且反应速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反应是气体体积减小的方向,因此采取的措施是增大压强或缩小容器的容积。
2 SO3(g)的正反应是气体体积减小的方向,因此采取的措施是增大压强或缩小容器的容积。