题目内容
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
(8分)(1)大于(2分)(2)A(2分) (3)升高温度(2分) 增大压强(2分)
【解析】
试题分析:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率。
(2)分别计算不同时间内的反应速率:0~1min内,v(H2)=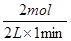 =1mol/(L?min);在1~3min内,v(H2)=
=1mol/(L?min);在1~3min内,v(H2)=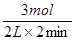 =0.75mol/(L?min);在3~8min内,v(H2)=
=0.75mol/(L?min);在3~8min内,v(H2)= =0.1mol/(L?min);根据图像可知,反应进行到8min时物质的浓度不再发生变化,反应达到平衡状态,则在8~11min内反应速率仍然是0.1mol/(L?min),所以0~1min内反应速率最大,故答案为A。
=0.1mol/(L?min);根据图像可知,反应进行到8min时物质的浓度不再发生变化,反应达到平衡状态,则在8~11min内反应速率仍然是0.1mol/(L?min),所以0~1min内反应速率最大,故答案为A。
(3)曲线I反应速率增大,但转化的氢气的物质的量少,应该是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强。
考点:考查反应速率的计算、外界条件对反应速率和平衡状态的影响
点评:该题是中等难度试题的考查,也是高考中的常见题型。主要是考查学生对反应速率计算以及外界条件影响反应速率和平衡状态的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和灵活应变能力。答题时注意把握对题目图象的分析和理解。


 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为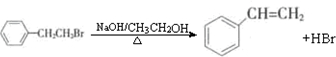

 (任写一种)
(任写一种) 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ
 CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,