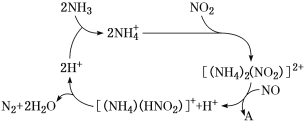
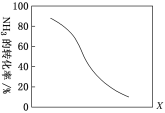
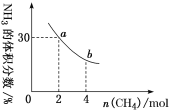
题目内容
【题目】下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
【答案】C
【解析】
A. 含有OH-的溶液也含有氢离子,两种离子浓度大小关系不能确定,故溶液不一定呈碱性,A错误;
B. pH为1的盐酸的c(H+)=10-1mol/L,pH为3的盐酸的c(H+)=10-3mol/L,所以前者氢离子浓度是后者氢离子浓度的100倍,B错误;
C. Na2 SO3溶液与NaHSO3溶液中所含微粒的种类一定相同,因为Na2SO3水解、NaHSO3既电离又水解,故它们均含有Na+、![]() 、
、![]() 、H2SO3、H2O、OH-、H+七种微粒,C正确;
、H2SO3、H2O、OH-、H+七种微粒,C正确;
D. pH相同的氨水与氢氧化钠溶液,因为一水合氨是弱电解质,故氨水的物质的量浓度比氢氧化钠大得多,当它们分别与同浓度同体积的盐酸完全中和时,消耗氨水的体积远小于氢氧化钠溶液的体积,D错误;
答案选C。

【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
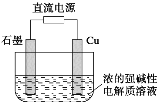
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
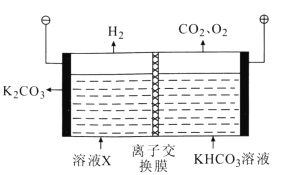
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。