题目内容
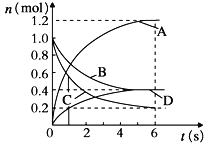
【题目】(一)有以下微粒:①N2H4 ②P4 ③H2O ④N2 ⑤H3O+ ⑥NH4+ ⑦CO2 ⑧H2O2
(填编号)
(1)既有极性键又有非极性键的是 ;(2)既有σ键又有π键的是 ;
(3)微粒中不含孤电子对的是____________;(4)立体构型呈正四面体的是____________;
(5)⑤和⑧的电子式分别为 和 ;
(6)⑥和⑦的结构式分别为 和 ;
(二)以下反应均为放热反应,根据热化学方程式,比较 △H1 和 △H2 的大小
① I2(g)+ H2(g)=2HI(g) △H1;I2(s)+ H2(g)=2HI(g) △H2,则△H1 △H2
② H2(g)+Cl2(g)=2HCl(g) △H1;H2(g)+Br2(g)=2HBr(g) △H2,则△H1 △H2
【答案】(一)(1)①⑧(2)④⑦ (3)⑥ (4)②⑥
(5)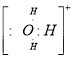
![]() (6)
(6)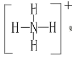 、
、![]()
(二)① < ②<
【解析】
试题分析:(1)同种元素的原子间形成非极性键、不同元素的原子形成极性键,既有极性键又有非极性键的是①⑧;
(2)单键是σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键;既有σ键又有π键的是④⑦;
(3)根据价层电子对互斥理论可知,N2H4中中心原子N原子含有的孤电子对数是(5-3×1)÷2=1;P4中心原子P原子含有的孤电子对数是(5-3×1)÷2=1;水中中心原子氧原子含有的孤电子对数是(6-2×1)÷2=2;N2每个N原子含有1对孤对电子;H3O+中心原子氧原子含有的孤电子对数是(6+3-1)÷2-3=1;NH4+中心原子氧原子含有的孤电子对数是(5+4-1)÷2-4=0;CO2中心原子氧原子含有的孤电子对数是0;H2O2中心原子氧原子含有的孤电子对,微粒中不含孤电子对的是⑥;
(4)立体构型呈正四面体的是②⑥;
(5)⑤和⑧的电子式分别为![]() 和
和![]() ;
;
(6)⑥和⑦的结构式分别为![]() 和
和![]()
(二)① 碘蒸汽的能量大于固体碘,气态碘放出的能量大,所以△H1 <△H2 ②氯化氢的键能大于溴化氢,所以△H1 <△H2。

【题目】蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中表述的蛋白质性质填空.
实例 | 性质 |
(1)紫外线消毒 | 变性 |
(2)蛋白质遇浓硝酸变黄 | |
(3)误食了重金属离子,可以立即喝大量的牛奶来缓解毒性 | |
(4)鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
(5))常用酒精清洗伤口 | |
(6)蒸煮鸡蛋食用 |