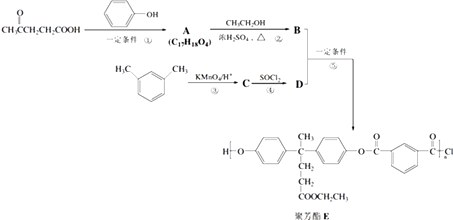
题目内容
【题目】氢能是一种极具发展潜力的清洁能源.以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:
完成下列填空
(1)反应Ⅰ的化学方程式是 . 反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层﹣﹣含低浓度I2的H2SO4层和高浓度的I2的HI层.
(2)根据上述事实,下列说法正确的是(选填序号).a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
(3)辨别两层溶液的方法: ,
(4)经检测,H2SO4层中c(H+):c(SO ![]() )=2.06:1.其比值大于2的原因是 . 反应Ⅱ:2H2SO4(l)→2SO2(g)+O2(g)+2H2O(g)﹣1100kJ 它由两步反应组成:
)=2.06:1.其比值大于2的原因是 . 反应Ⅱ:2H2SO4(l)→2SO2(g)+O2(g)+2H2O(g)﹣1100kJ 它由两步反应组成:
i.H2SO4(l)→SO3(g)+H2O(g)﹣177kJ ii.SO3(g)分解.
L(L1、L2),X可分别代表压强或温度.图2表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系.
(5)X代表的物理量是 , 推断的依据是 .
(6)判断L1和L2的大小,并简述理由 .
【答案】
(1)SO2+2H2O+I2=H2SO4+2HI
(2)ac
(3)观察颜色|颜色深的为HI层,颜色浅的为硫酸层
(4)硫酸层中含少量的HI,且HI电离出氢离子
(5)压强;增大压强平衡逆向进行,三氧化硫转化率减小
(6)L1<L2 , 分解反应为吸热反应,温度高,三氧化硫转化率大
【解析】解:(1)由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,所以答案是:SO2+2H2O+I2=H2SO4+2HI;(2)a.两层溶液的密度存在差,才出现上下层,故a正确;b.加I2前,H2SO4溶液和HI溶液互溶,与分层无关,故b错误;c.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,与分层有关,故c正确;所以答案是:ac;(3)辨别两层溶液的方法是观察颜色,颜色深的为HI层,颜色浅的为硫酸层,所以答案是:观察颜色,颜色深的为HI层,颜色浅的为硫酸层;(4)H2SO4层中c(H+):c(SO42﹣)=2.06:1.其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子,所以答案是:硫酸层中含少量的HI,且HI电离出氢离子;(5)由图可知,X越大,三氧化硫转化率越低,升高温度转化率增大不符合,增大压强平衡逆向进行,三氧化硫转化率减小,图象符合X表示压强,所以答案是:压强,增大压强平衡逆向进行,三氧化硫转化率减小;(6)由2SO3(g)=2SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2 , 所以答案是:L1<L2 , 分解反应为吸热反应,温度高,三氧化硫转化率大.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案