题目内容
【题目】(1)在下列物质中: a.CaCl2 b.KOH c.NH3 d.H2SO4 e.NH4Cl f.CH2=CH2 g.N2
①只含有共价键的非电解质是____________ (填序号,下同);
②含有共价键的离子化合物是____________.
(2)下列各图是元素有关性质随原子序数递增的变化曲线,把正确的标号填入相应空格中:


①第三周期元素的常见最高化合价________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________。
(3)有机物的结构可用“键线式”表示,如CH3CH2CH2CH3可简写为![]() 。已知某烷烃的“键线式”为:
。已知某烷烃的“键线式”为:![]()
①用系统命名法命名该烷烃:________________________________________。
②若该烷烃是由烯烃和1molH2加成得到的,则原烯烃的结构有种__________。(不包括立体异构,下同)
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
【答案】cf be D E 2,2,5,5-四甲基-3-乙基己烷 3 6
【解析】
(1)①只含有共价键的物质有NH3、H2SO4、CH2=CH2和N2;
②CaCl2、KOH、NH4Cl是离子化合物;
(2)①因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大;
②核外电子数相同,则核内质子数越多半径越小;同主族元素,随核电荷数增大,离子半径依次增大;
(3) ①![]() 的结构简式为CH3C(CH3)2CH((CH2CH3)CH2C(CH3)3;
的结构简式为CH3C(CH3)2CH((CH2CH3)CH2C(CH3)3;
②若此烷烃为单烯烃加氢制得,烷烃中相邻的碳原子上必须都有氢原子;
③该烷烃在光照条件下与氯气反应,生成一氯代烷时,注意没有连有氢原子的碳原子不能发生取代反应,连在同一碳原子上的相同烷基,具有相同的取代效果。
(1)①只含有共价键的物质有NH3、H2SO4、CH2=CH2和N2,其中H2SO4属于电解质,N2是单质,既不是电解质非电解质,NH3和CH2=CH2属于非电解质,故答案为:cf;
②CaCl2、KOH、NH4Cl是离子化合物,CaCl2只含有离子键,KOH和NH4Cl含有离子键和共价键,故答案为:be;
(2)①因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故选D,故答案为:D;
②核外电子数相同,则核内质子数越多半径越小;同主族元素,随核电荷数增大,离子半径依次增大,所以离子半径为:P3->S2–>Cl–>Na+>Mg2+>Al3+,故选E;
(3) ①![]() 的结构简式为CH3C(CH3)2CH((CH2CH3)CH2C(CH3)3,最长碳链含有6个碳,支链为4个甲基和1个乙基,该烷烃的名称为2,2,5,5-四甲基-3-乙基己烷,故答案为:2,2,5,5-四甲基-3-乙基己烷;
的结构简式为CH3C(CH3)2CH((CH2CH3)CH2C(CH3)3,最长碳链含有6个碳,支链为4个甲基和1个乙基,该烷烃的名称为2,2,5,5-四甲基-3-乙基己烷,故答案为:2,2,5,5-四甲基-3-乙基己烷;
②若此烷烃为单烯烃加氢制得,烷烃中相邻的碳原子上必须都有氢原子,则此烯烃的结构有3种,双键位置如下列碳干结构中的编号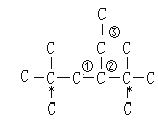 (标注*的碳原子为无氢碳原子),故答案为:3;
(标注*的碳原子为无氢碳原子),故答案为:3;
③该烷烃在光照条件下与氯气反应,生成一氯代烷时,注意没有连有氢原子的碳原子不能发生取代反应,连在同一碳原子上的相同烷基,具有相同的取代效果,则生成的一氯代烷最多有6种,取代位置如下列碳干结构中的编号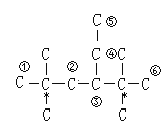 (标注*的碳原子为无氢碳原子),故答案为:6。
(标注*的碳原子为无氢碳原子),故答案为:6。