题目内容
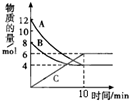 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,根据题意回答问题:
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,根据题意回答问题:(1)反应开始到10min,A的物质的量减少了
(2)反应开始到10min用C表示的反应速率为
(3)反应开始到10min时,B的转化率为
(4)该反应的化学方程式为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)图象分析A物质的量在10min减少为12mol-6mol=8mol;
(2)依据反应越速率概念计算,V=
计算得到;
(3)转化率=
×100%;
(4)分析图象中ABC消耗量和生成量,化学方程式系数之比等于变化的物质的量之比,得到最简比书写化学方程式;
(2)依据反应越速率概念计算,V=
| △c |
| △t |
(3)转化率=
| 消耗量 |
| 起始量 |
(4)分析图象中ABC消耗量和生成量,化学方程式系数之比等于变化的物质的量之比,得到最简比书写化学方程式;
解答:
解:(1)图象分析反应开始到10min,A物质的量在10min减少为12mol-6mol=8mol
故答案为:8mol;
(2)反应开始到10min用C表示的反应速率=
=0.3mol/L?min;
(3)反应开始到10min时,B的转化率=
×100%=50%;
故答案为:50%;
(4)图象分析可知AB物质的量减小为反应物,C物质的量增大为生成物,A消耗物质的量=12mol-4mol=8mol,B消耗物质的量=8mol-4mol=4mol,C生成物质的量6mol,n(A):n(B):n(C)=8:4:6=4:2:3,反应的化学方程式为:4A+2B?3C;
故答案为:4A+2B?3C;
故答案为:8mol;
(2)反应开始到10min用C表示的反应速率=
| ||
| 10min |
(3)反应开始到10min时,B的转化率=
| 8mol-4mol |
| 8mol |
故答案为:50%;
(4)图象分析可知AB物质的量减小为反应物,C物质的量增大为生成物,A消耗物质的量=12mol-4mol=8mol,B消耗物质的量=8mol-4mol=4mol,C生成物质的量6mol,n(A):n(B):n(C)=8:4:6=4:2:3,反应的化学方程式为:4A+2B?3C;
故答案为:4A+2B?3C;
点评:本题考查了化学反应速率、转化率计算应用,注意图象中物质消耗与生成的物质的量计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
现有①Al2(SO4)3 ②Cu(NO3)2 ③Ba(OH)2 ④NH4Cl ⑤NaNO3五种溶液,不用其它试剂能将一一鉴别出来的顺序是( )
| A、①②③④⑤ |
| B、②③④①⑤ |
| C、②④③①⑤ |
| D、②⑤③①④ |
下列各组失去标签的溶液,不另加其他试剂(仅利用组内物质间的反应),运用试管和胶头滴管就能区别开来的是( )
| A、FeCl3、NaOH、KSCN、Ba(NO3)2 |
| B、NaCl、Na2CO3、KNO3、HCl |
| C、BaCl2、Na2SO4、NaOH、NaCl |
| D、Na2SO4、BaCl2、K2CO3、KNO3 |
下列有关说法正确的是( )
| A、铅蓄电池在放电时,两极质量均增加 | ||
| B、钢铁在中性溶液中主要发生析氢腐蚀 | ||
| C、在室温下能自发进行的反应,其△H一定小于0 | ||
D、0.1mol?L-1 Na2S溶液加水稀释时,
|
 近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.