��Ŀ����
����Ŀ����ͼ�Dzⶨ���ۣ���ͭ�۵����ʲ����ᷴӦ���Ĵ��ȵ�ʵ��װ�ã�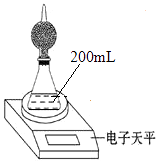
װ��Ϊ����ܺ���ƿ���������װ���Ȼ��ƣ���ƿ�����õ����ᣨ�����������ʵ���Ũ��Ϊ4molL��1 �� ��ͬʱ�������ƽ�Ķ������±���ʾ��
ʵ����� | t/min | ������ƽ�Ķ���/g |
װ��+������Һ | 320.0 | |
װ��+������Һ+��Ʒ | 0 | 335.0 |
1 | 334.5 | |
2 | 334.1 | |
3 | 333.8 | |
4 | 333.8 |
�ٷ�Ӧ���������������Ϊ ��
���Լ�����Ʒ������������������д��������̣�
����Ӧ����ƿ��������Һ����Һ������仯���ԣ������ʵ�����Ũ������д��������̣�
���𰸡�1.2g��![]() ��100%=72.0%��
��100%=72.0%��![]() =1mol/L
=1mol/L
���������⣺�ٷ�Ӧ���������������Ϊ335.0g��333.8g=1.2g��
���躬AlΪxg����
2Al+3H2SO4=Al2��SO4��3+ | 3H2�� |
54 | 6 |
x | 1.2g |
![]() �����x=10.8g��
�����x=10.8g��
����Ʒ��������������Ϊ ![]() ��100%=72.0%��
��100%=72.0%��
����Ʒ��������������Ϊ72.0%��
�����������ʵ���Ϊ ![]() =0.6mol���ɷ�Ӧ��֪���μӷ�Ӧ����������ʵ���Ϊ0.6mol��ʣ����������ʵ���Ϊ0.2L��4mol/L��0.6mol=0.2mol����Ӧ����ƿ��������Һ����Һ������仯���ԣ������ʵ�����Ũ��Ϊ
=0.6mol���ɷ�Ӧ��֪���μӷ�Ӧ����������ʵ���Ϊ0.6mol��ʣ����������ʵ���Ϊ0.2L��4mol/L��0.6mol=0.2mol����Ӧ����ƿ��������Һ����Һ������仯���ԣ������ʵ�����Ũ��Ϊ ![]() =1mol/L��
=1mol/L��
�����ʵ���Ũ��1mol/L��
���Դ��ǣ���1.2g����72.0%����1mol/L��

