题目内容
2.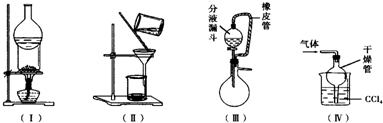 下列实验装置用途正确的是( )
下列实验装置用途正确的是( )| A. | 装置(Ⅰ)可用于I2与NH4Cl混合物的分离 | |
| B. | 装置(Ⅱ)用于分离Fe(OH)3胶体和FeCl3溶液 | |
| C. | 装置(Ⅲ)橡皮管起到平衡气压,使液体顺利流下的作用 | |
| D. | 装置(Ⅳ)用于吸收HCl或NH3 |
分析 A.装置(I)适用于加热时易升华或易分解的物质,且易分解的物质冷却后能生成固体;
B.装置(II)适用于分离不溶性固体和液体;
C.当分液漏斗上部压强大于烧瓶内压强时,分液漏斗内液体才能顺利流下;
D.有缓冲装置的能防止倒吸,且尾气处理中,尾气能溶于该溶液.
解答 解:A.加热时碘易升华、氯化铵易分解,且氯化铵分解生成的气体遇冷会生成氯化铵固体,所以该装置不能用于分离碘和氯化铵,故A错误;
B.装置(II)适用于分离不溶性固体和液体,Fe(OH)3胶体和FeCl3溶液都能透过滤纸,所以不能用过滤方法分离,应该采用渗析方法分离,故B错误;
C.当分液漏斗上部压强大于烧瓶内压强时,分液漏斗内液体才能顺利流下,所以橡皮管起到平衡气压,使液体顺利流下的作用,故C正确;
D.该装置有缓冲作用,但四氯化碳不能吸收HCl或氨气,应该用水,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离和提纯、尾气处理等实验基本操作,明确实验原理是解本题关键,知道物质分离基本方法,注意C中橡皮管作用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.已知:甲$→_{石墨电极}^{电解}$乙$\stackrel{H_{2}}{→}$丙,若丙的水溶液显酸性,则甲可能为( )
| A. | NaCl | B. | KOH | C. | Al2O3 | D. | MgSO4溶液 |
17.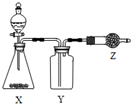 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )| 选项 | X | Y | Z |
| A | 食盐、浓硫酸 | HCl | 碱石灰 |
| B | CaO、浓氨水 | NH3 | 无水CaCl2 |
| C | Cu、浓硝酸 | NO2 | 碱石灰 |
| D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
| A. | A | B. | B | C. | C | D. | D |
3.能确认水是由氢元素和氧元素组成的实验是( )
| A. | 水的蒸馏 | B. | 水的净化 | C. | 水的蒸发 | D. | 水的电解 |
4.下列有机物水解时,断键位置不正确的是( )
①
②
③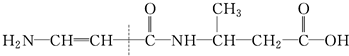
④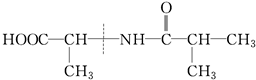
①

②

③
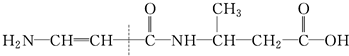
④

| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.