题目内容
(2010?桂林一模)常温下,对下列各溶液的叙述不正确的是( )
分析:A、根据物料守恒和电荷守恒确定氢氧根离子和氢离子、醋酸分子浓度的关系.
B、根据电荷守恒结合溶液的酸碱性计算钠离子浓度和氟离子浓度之差.
C、根据溶液的酸碱性及电中性判断氢离子和氢氧根离子浓度的关系.
D、加入相同的离子,能抑制弱电解质的电离.
B、根据电荷守恒结合溶液的酸碱性计算钠离子浓度和氟离子浓度之差.
C、根据溶液的酸碱性及电中性判断氢离子和氢氧根离子浓度的关系.
D、加入相同的离子,能抑制弱电解质的电离.
解答:解:A、醋酸钠溶液呈电中性,所以溶液中阴阳离子所带电荷相等,即c(OH-)+c(CH3COO-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COOH),故A正确.
B、常温下,PH=8的NaF溶液中,c(OH-)=10-6 mol/L,c(H+)=10-8 mol/L,根据电荷守恒得c(OH-)+c(F-)=c(H+)+c(Na+),所以c(Na+)-c(F-)=c(OH-)-c(H+)=10-6 mol/L-10-8 mol/L=9.9×10-7mol/L,故B正确.
C、PH=2的盐酸溶液中氢离子浓度是0.01mol/L,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,氯化氢和氢氧化钡都是强电解质,所以氢离子和氢氧根离子恰好反应,溶液呈中性,溶液中c(H+)=c(OH-),故C正确.
D、向氨水中加入氯化铵后,铵根离子浓度增大能抑制氨水的电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以溶液中c(OH-)/c(NH3?H2O)减小,故D错误.
故选D.
B、常温下,PH=8的NaF溶液中,c(OH-)=10-6 mol/L,c(H+)=10-8 mol/L,根据电荷守恒得c(OH-)+c(F-)=c(H+)+c(Na+),所以c(Na+)-c(F-)=c(OH-)-c(H+)=10-6 mol/L-10-8 mol/L=9.9×10-7mol/L,故B正确.
C、PH=2的盐酸溶液中氢离子浓度是0.01mol/L,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,氯化氢和氢氧化钡都是强电解质,所以氢离子和氢氧根离子恰好反应,溶液呈中性,溶液中c(H+)=c(OH-),故C正确.
D、向氨水中加入氯化铵后,铵根离子浓度增大能抑制氨水的电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以溶液中c(OH-)/c(NH3?H2O)减小,故D错误.
故选D.
点评:本题考查了离子浓度大小的比较,难度较大,易错选项是B,能熟练运用电荷守恒和物料守恒是解本题的关键.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
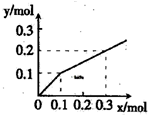 (2010?桂林一模)以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
(2010?桂林一模)以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( ) (2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).
(2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).