题目内容
(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
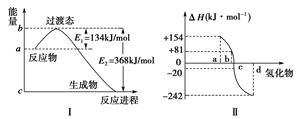
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。
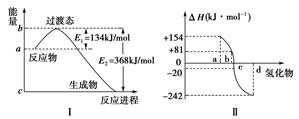
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
(1)NO2(g)+CO(g)===NO(g)+CO2(g);ΔH=-234 kJ·mol-1
(2)H2Se(g)===Se(g)+H2(g);ΔH=+81 kJ/mol
(3)FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH=-11 kJ·mol-1
【解析】
试题分析:(1)正确书写热化学方程式,?要指明反应时的温度和压强;?方程式中所有的反应物和产物都要用括号注明它们在反应时的状态;?写出反应的焓变,注意焓变的正负号。(2)根据元素周期律可知氧族元素的氧、硫、硒、碲在生成氢化物时由易变难,反应由放热反应变为吸热反应,所以a--碲,b--硒;c--硫;d--氧;由图可看出硒发生反应的焓变为+80KJ/mol。(3)将?×3—(?+?×2)再除以6即可得到CO还原FeO的热化学方程式和反应焓变
考点:热化学方程式的书写、化学反应焓变的判断、化学反应热的计算
点评:本题属于比较基础的填空题,热化学知识在高考中占有比较重要的位置