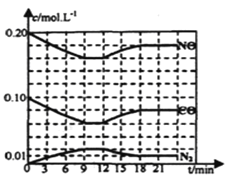
题目内容
【题目】25℃时,向![]() 二元酸
二元酸![]() 溶液中滴加
溶液中滴加![]() 溶液,有关微粒物质的量变化如图。下列叙述正确的是
溶液,有关微粒物质的量变化如图。下列叙述正确的是

A.等体积等浓度的![]() 溶液与
溶液与![]() 溶液混合后,其溶液中水的电离程度比纯水中的大
溶液混合后,其溶液中水的电离程度比纯水中的大
B.![]() 时,溶液中存在:
时,溶液中存在:![]()
C.当![]() 时,升高温度,
时,升高温度,![]() 减小
减小
D.当![]() 时,溶液中各离子浓度的大小顺序为:
时,溶液中各离子浓度的大小顺序为:![]()
【答案】B
【解析】
A.等体积等浓度的NaOH溶液与H2A溶液混合后,得到NaHA的溶液,由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,溶液中水的电离程度比纯水中的小,故A错误;
B.![]() 时,NaOH溶液与H2A溶液反应得到NaHA的溶液,溶液中存在物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),也存在电荷守恒:c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH-),处理得
时,NaOH溶液与H2A溶液反应得到NaHA的溶液,溶液中存在物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),也存在电荷守恒:c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH-),处理得![]() ,故B正确;
,故B正确;
C.向![]() 二元酸H2A溶液中滴加0.2mol·L-lNaOH溶液40mL,反应后得到Na2A溶液,A2-离子水解溶液显碱性,加热促进水解,A2-离子浓度减小,钠离子浓度不变,则
二元酸H2A溶液中滴加0.2mol·L-lNaOH溶液40mL,反应后得到Na2A溶液,A2-离子水解溶液显碱性,加热促进水解,A2-离子浓度减小,钠离子浓度不变,则![]() 的比值增大,故C错误;
的比值增大,故C错误;
D.根据图象知,当V(NaOH)=20 mL时,发生反应为NaOH+H2A═NaHA+H2O,溶质为NaHA,HA-电离程度大于水解程度,溶液显酸性,水和HA-都电离出氢离子,只有HA-电离出A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D错误;
故选B。

【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
W | X | Y | Z | |
结构 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 | 最高正价与最 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中Y的质量分数的数据有 (填序号)。
A.m、n B.m、y C.n、y