题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
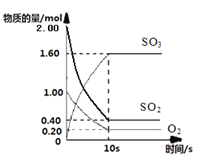
①反应的化学方程式为
②反应开始到10s,用SO2表示的反应速率为
③O2的平衡转化率为
(2)对于反应:2SO2(g)+O2(g)![]() 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(3)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_________kJ·mol-1。
(4)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO2
【答案】22.(1)①2SO2(g)+O2(g)![]() 2SO3(g)②ν(SO2)=0.08mol/(L·s)③80%
2SO3(g)②ν(SO2)=0.08mol/(L·s)③80%
(2)0.025mol·L-1·min-1;0.05mol·L-1·min-1(3)-41.8(4)b、d
【解析】
试题分析:(1)①根据图提供的信息,SO2和氧气不断减少,属于反应物,SO3的量不断增加,属于生成物,且0-10s内,各物质的变化量为Δn(SO2): Δn(O2): Δn(SO3)=(2.00-0.40):(1.00-0.20):(1.60)=2:1:2,则反应的化学方程式为2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g);
②ν(SO2)= 1.6mol÷(2L×10s)=0.08mol/(L·s)。
③O2的平衡转化率为0.80÷1.0×100%=80%。
(2)根据化学反应速率之比等于化学计量数之比,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=0.025 mol·L-1·min-1;;υ(SO3)= 0.05 mol·L-1·min-1。
(3)①2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6kJmol-1、②2NO(g)+O2(g)
2SO3(g)△H=-196.6kJmol-1、②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,利用盖斯定律将①×1/2-②×1/2得:NO2(g)+SO2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,利用盖斯定律将①×1/2-②×1/2得:NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=-41.8kJmol-1。
SO3(g)+NO(g)△H=-41.8kJmol-1。
(4)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,a项错误;b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,b项正确;c.由方程式可知,SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,c项错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,d项错误;答案选b、d。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案