题目内容
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
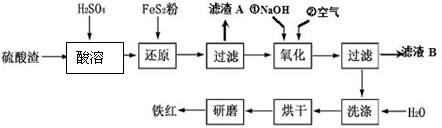
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2+14Fe3++
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
(5)已知每煅烧16g FeS2,放出106.5kJ热量,写出FeS2燃烧的热化学方程式 和
和
 和
和 (写出元素符号并标出相应的化合价).
(写出元素符号并标出相应的化合价).

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀p H | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
;“滤渣A”主要成份的化学式为SiO2
SiO2
.(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2+14Fe3++
8
8
H2O═15Fe2++2
2
SO42-+16H+
16H+
.(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓
.(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
3.2~3.8
3.2~3.8
(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4
Na2SO4、Al2(SO4)3、MgSO4
.(5)已知每煅烧16g FeS2,放出106.5kJ热量,写出FeS2燃烧的热化学方程式
FeS2(s)+
O2(g)
Fe2O3(s)+2SO2(g);△H=-798.75kJ/mol
| 11 |
| 4 |
| ||
| 1 |
| 2 |
FeS2(s)+
O2(g)
Fe2O3(s)+2SO2(g);△H=-798.75kJ/mol
.该反应中被氧化的元素是| 11 |
| 4 |
| ||
| 1 |
| 2 |
 和
和
 和
和
分析:(1)氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
(2)根据原子守恒来配平;
(3)NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
(4)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠;
(5)计算出1mol FeS2燃烧放出的热量即可写出热化学方程式,标出化合价的变化即可知道被氧化的元素.
(2)根据原子守恒来配平;
(3)NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
(4)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠;
(5)计算出1mol FeS2燃烧放出的热量即可写出热化学方程式,标出化合价的变化即可知道被氧化的元素.
解答:解:(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2;
(2)根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16.故答案为:8;2;16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间;未沉淀的离子为
Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:3.2~3.8(或之间的数据值);Na2SO4、Al2(SO4)3、MgSO4;
(5)1mol FeS2燃烧放出的热量为:106.5KJ÷16×120═798.75kJ,标出化合价,可知铁和硫的化合价升高,所以被氧化的为铁和硫元素.
故答案为:FeS2(s)+
O2(g)
Fe2O3(s)+2SO2(g);△H=-798.75kJ/mol; 和
和 .
.
故答案为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2;
(2)根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16.故答案为:8;2;16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间;未沉淀的离子为
Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:3.2~3.8(或之间的数据值);Na2SO4、Al2(SO4)3、MgSO4;
(5)1mol FeS2燃烧放出的热量为:106.5KJ÷16×120═798.75kJ,标出化合价,可知铁和硫的化合价升高,所以被氧化的为铁和硫元素.
故答案为:FeS2(s)+
| 11 |
| 4 |
| ||
| 1 |
| 2 |
 和
和 .
.点评:本题以铁及其化合物为载体,以流程图形式考查了化学用语的书写和氧化还原反应知识.复习元素化合物应和实验、化学基础理论和化学用语结合起来.

练习册系列答案
相关题目
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:

(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
|
完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
 (2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.