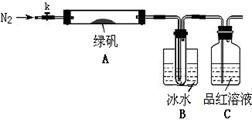
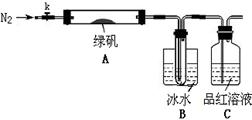
题目内容
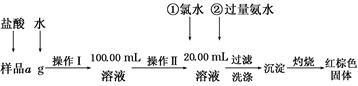
已知常温下D、E、F、H、L、N均为气体;A的焰色反应呈黄色;向B的溶液中滴加KSCN溶液,无明显现象;1 mol B隔绝空气分解得到F、G、H三种氧化物,其物质的量均为1 mol;F是易与血红蛋白结合的物质;J是现代社会中应用最广泛的金属单质。

请回答下列题:
(1)B的化学式为________;H的结构式为________
(2)电解A溶液的离子方程式为______________________________________
(3)D与E反应可制得一种重要的化工原料,其反应的现象是____________________________
(4)F与G反应的化学方程式为________________________________

请回答下列题:
(1)B的化学式为________;H的结构式为________
(2)电解A溶液的离子方程式为______________________________________
(3)D与E反应可制得一种重要的化工原料,其反应的现象是____________________________
(4)F与G反应的化学方程式为________________________________
(1)FeC2O4 O=C=O (2)2Cl-+2H2O H2↑+Cl2↑+2OH- (3)苍白色火焰,放出大量热 (4)FeO+CO
H2↑+Cl2↑+2OH- (3)苍白色火焰,放出大量热 (4)FeO+CO Fe+CO2
Fe+CO2
 H2↑+Cl2↑+2OH- (3)苍白色火焰,放出大量热 (4)FeO+CO
H2↑+Cl2↑+2OH- (3)苍白色火焰,放出大量热 (4)FeO+CO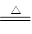 Fe+CO2
Fe+CO2A的焰色反应呈黄色,电解A溶液得到气体D、E,可知A为氯化钠,则C为NaOH,Ⅰ为HCl。红褐色固体为Fe(OH)3,则M为Fe(OH)2,则单质J为铁,E为氢气。E与L在高温高压下合成N,则N为NH3,L为N2,NH3与CO2反应生成尿素,H为CO2。F是易与血红蛋白结合的物质,则F为CO,G是FeO。本题易错在G的判断上,可能认为G为三氧化二铁,题中能生成CO、CO2的为C2O42—,而C2O42—有还原性,不能与Fe3+共存,所以B中铁为+2价。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目