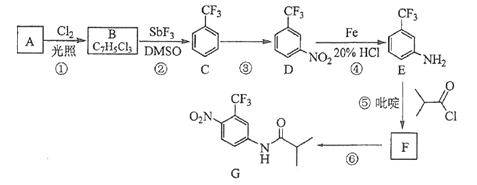
��Ŀ����
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɣ�
��1������ ����ͬѧ��a��b��c��ֻ�ձ���ֱ����50mLˮ���ٷֱ�μӼ��η�̪��Һ�����μ����С�����ﮡ��ơ��ؿ飬�۲�����
��ͬѧ���ʵ���Ŀ���� �� �ձ�������ĸ���еķ�Ӧ����ң�
���� ����ͬѧ���ʵ����֤�ǽ���Ԫ�صķǽ�����Խǿ����Ӧ����ۺ���������Ծ�Խǿ�����������ͼװ������֤����̼����Ԫ�صķǽ�����ǿ����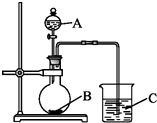
��ͬѧ��Ƶ�ʵ���ֱ��֤�������������ǿ������֪A��ǿ�ᣬ�����¿���ͭ��Ӧ��B�ǿ�״���壻��Һ©���Ļ�����C�пɹ۲쵽�а�ɫ�������ɣ�
д����ѡ�����ʵĻ�ѧʽ��A����B���� C�� ��
��2��д���ձ��з�����Ӧ�����ӷ���ʽ��
��3����װ�ô�����ij��ȱ�ݣ��Ľ��ķ����� ��
���𰸡�
��1��ﮡ��ơ��صĻ�ԣ���ͬһ���壬���ϵ���Ԫ�صĽ���������ǿ����c��HNO3��CaCO3��Na2SiO3����K2SiO3��
��2��CO2+SiO32��+H2O�TH2SiO3��+CO32����2CO2+SiO32��+2H2O�TH2SiO3��+2HCO3��
��3����B��C֮������һ��ʢ�б���̼��������Һ��ϴ��ƿ
���������⣺��1���⼸�ֽ������ʶ�����ˮ��Ӧ��������������Ӧ���ҳ̶Ȳ�ͬ�����ҳ̶Ȳ�ͬ˵�������Ļ����Բ�ͬ�����Ը�ʵ��Ŀ������֤ﮡ��ơ��صĻ�ԣ���ͬһ���壬���ϵ���Ԫ�صĽ���������ǿ���������Ľ�����Խǿ���䵥����ˮ���ᷴӦԽ���ң��⼸�ֽ����Ľ�������ǿ����K����c�з�Ӧ����ң����Դ��ǣ�ﮡ��ơ��صĻ�ԣ���ͬһ���壬���ϵ���Ԫ�صĽ���������ǿ����c��ǿ���ܺ������η�Ӧ�������ᣬҪ֤��N��C��SiԪ�طǽ�����ǿ���������������̼���η�Ӧ��Ȼ�������ɵĶ�����̼������Թ����η�Ӧ��֤��������A����HNO3��B����̼��ơ�C����Na2SiO3����K2SiO3��
�� ���Դ��ǣ�HNO3��CaCO3��Na2SiO3����K2SiO3������2��CO2��H2O�Ϳ����Թ����η�Ӧ���ɹ������ͬʱ����̼���λ�̼�����Σ������ӷ���ʽΪCO2+SiO32��+H2O�TH2SiO3��+CO32����2CO2+SiO32��+2H2O�TH2SiO3��+2HCO3�� �� ���Դ��ǣ�CO2+SiO32��+H2O�TH2SiO3��+CO32����2CO2+SiO32��+2H2O�TH2SiO3��+2HCO3������3��������лӷ��ԣ��������ɵĶ�����̼�к������ᣬ����Ϳ����Թ����η�Ӧ���������ԵĹ��ᣬ��Ӱ�������̼��������Һ�ķ�Ӧ��������Ľ�����Ϊ��B��C ֮������һ��ʢ�б���̼��������Һ��ϴ��ƿ�����Դ��ǣ���B��C ֮������һ��ʢ�б���̼��������Һ��ϴ��ƿ��