题目内容
下列图示与对应的叙述相符的是( )

| A.图1表明可用蒸馏法分离X、Y |
| B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2 |
| C.图3表示向盐酸和醋酸混合溶液中滴入氨水 |
| D.图4表示曲线b过程的热化学方程式:N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ· |
D
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符合的是( )
| A.大力研发新型有机溶剂替代水作为萃取剂 |
| B.加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 |
| C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| D.甲烷和乙醇的燃烧热分别是891.0 kJ·mol-1、1366.8 kJ·mol-1,利用甲烷更“低碳” |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
已知断裂1 mol H2和1 mol Cl2中的化学键吸收的能量分别为436 kJ、243 kJ,而由H
原子和Cl原子形成1 mol HCl时释放的能量为431 kJ。则下列热化学方程式中正确的是( )
A. H2(g)+ H2(g)+ Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1 Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1 |
| B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1 |
C.HCl(g)= H2(g)+ H2(g)+ Cl2(g)ΔH=-91.5 kJ·mol-1 Cl2(g)ΔH=-91.5 kJ·mol-1 |
| D.H2(g)+Cl2(g)=2HCl(g) ΔH=+248 kJ·mol-1 |
在298 K、100 kPa时,已知:
2H2O(g) 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g) 2HCl(g) ΔH2
2HCl(g) ΔH2
2Cl2+2H2O(g) 4HCl(g)+O2(g) ΔH3
4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是( )
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+O2(g)  NO(g)+H2O(g) ΔH="-a" kJ·mol-1 NO(g)+H2O(g) ΔH="-a" kJ·mol-1 |
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1 6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1 |
C.2CO(g)+O2(g) 2CO2(g) ΔH="-c" kJ·mol-1 2CO2(g) ΔH="-c" kJ·mol-1 |
D.CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1 CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1 |
下列说法正确的是( )
| A.焓变是指1 mol物质参加反应时的能量变化 |
| B.当反应放热时ΔH>0,反应吸热时ΔH<0 |
| C.在加热条件下发生的反应均为吸热反应 |
| D.一个化学反应中,当反应物总能量大于生成物总能量时,ΔH为“-” |
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+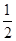 O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于( )
| A.-417.91 kJ·mol-1 | B.-319.68 kJ·mol-1 |
| C.+546.69 kJ·mol-1 | D.-448.46 kJ·mol-1 |
已知反应:
①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列结论正确的是 ( )。
| A.碳的燃烧热的数值大于110.5 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |