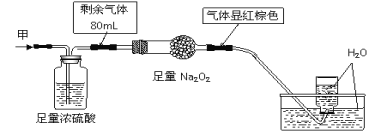
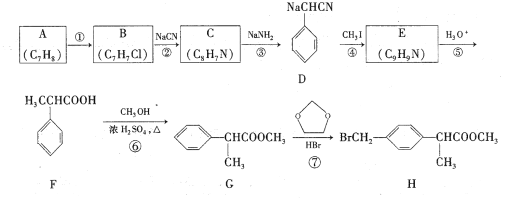
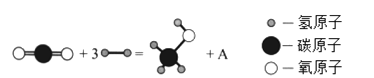
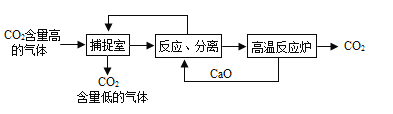
题目内容
【题目】下列变化中,必须加入还原剂才能发生的是( )
A.SO2→SB.S→SO2
C.SO32﹣→SO2D.HCO3﹣→CO32﹣
【答案】A
【解析】
A. SO2→S中硫元素化合价降低,则需要加入还原剂才能实现,故A正确;
B. S→SO2中硫元素化合价升高,则需要加入氧化剂才能实现,故B错误;
C. SO32-→SO2中硫元素、氧元素化合价都不变,需要加入强酸才能实现,故C错误;
D. HCO3﹣→CO32﹣中C元素、O元素化合价都不变,需要加入强碱才能实现,故D错误;
正确答案是A。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目