题目内容
2.NH3可消除NO的污染,反应方程式为:6NO+4NH3=5N2+6H2O.现有NO与NH3的混合物共1mol充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )| A. | 原混合物中NO与NH3的物质的量之比可能为3:2 | |
| B. | 有0.6 mol NH3被氧化 | |
| C. | 生成还原产物2.8g | |
| D. | 原混合气体中含氨气为0.2 mol或0.7 mol |
分析 反应的方程式为:6NO+4NH3=5N2+6H2O,反应中NO中N元素的化合价由+2价降低到0价,得电子,NH3中N元素的化合价由-3价升高到0价,失电子,根据化学方程式以及经还原得到的N2比经氧化得到的N2多1.4g,利用讨论法计算原反应混合物中NO与NH3的物质的量.
解答 解:6molNO还原得到3molN2,4molNH3氧化得到2molN2,两者相差1molN2,现相差1.4g,$\frac{1.4g}{28g/mol}$=0.05mol,
相当于0.3molNO和0.2molNH3反应,
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,
所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO.
A.气体有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO,二者比值不是3:2,故A错误;
B.由以上分析可知,有0.3 mol NO被还原,0.2molNH3被氧化,故B错误;
C.由N原子守恒可知,0.3 mol NO被还原,对应还原产物N2为0.15mol,其质量为0.15mol×28g/mol=4.2g,故C错误;
D.由上述分析可知,原混合气体中含氨气为0.2 mol或0.7 mol,故D正确.
故选D.
点评 本题考查氧化还原反应以及有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意根据化学方程式判断被氧化和被还原的物质的量的关系为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.A、B、C、D均为短周期元素,在周期表中的位置如图所示:
回答下列问题:
(1)A、B、D的元素符号为:C、N、Cl;C元素位于周期表中三周期VIA族.
(2)D的单质和水反应的化学方程式为:Cl2+H2O=HCl+HClO;
(3)D的最高价氧化物的水化物的化学式为:HClO4,其酸性大于(填大于或小于) C的最高价氧化物的水化物的酸性;B的氢化物的水溶液呈碱性(填酸性或碱性).
(4)A的氢化物的结构式为: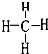 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
| A | B | |||
| C | D | |||
(1)A、B、D的元素符号为:C、N、Cl;C元素位于周期表中三周期VIA族.
(2)D的单质和水反应的化学方程式为:Cl2+H2O=HCl+HClO;
(3)D的最高价氧化物的水化物的化学式为:HClO4,其酸性大于(填大于或小于) C的最高价氧化物的水化物的酸性;B的氢化物的水溶液呈碱性(填酸性或碱性).
(4)A的氢化物的结构式为:
 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
13.粒子甲在溶液中的转化关系如图所示,粒子甲不可能是( )

| A. | NH4 + | B. | Al(OH)3 | C. | S | D. | Al |
10.在密闭容器中A与B反应生成C,一段时间内其化学反应速率分别用v(A)、v(B)、v(C)表示.已知v(A)、v(B)、v(C)之间有以下关系2v(B)=v(A),v(C)=3v(B),则此反应可表示为( )
| A. | 2A+3B=2C | B. | A十3B=2C | C. | 2A+B=3C | D. | A+B=C |
17.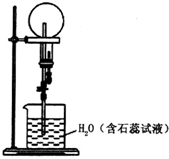 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )
 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )| A. | NH3和HCl分别形成蓝色、红色喷泉 | |
| B. | 制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
14.X(盐)和Y(酸)反应,可放出有气味的气体Z,Z跟过量NaOH反应又得到X,Z氧化的最终产物为W气,W气溶于水又得到Y,则X和Y是( )
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4.
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4.
| A. | 只有① | B. | ①② | C. | ②③ | D. | ①④ |
12.下列物质中,属于纯净物的是( )
| A. | 石油 | B. | 食醋 | C. | 液态氧 | D. | 水泥砂浆 |
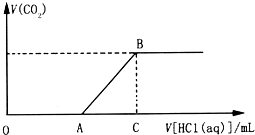 向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0mol•L-1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):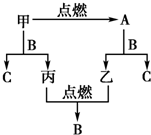 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.