题目内容
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
分析:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,结合化合价规则与常见物质化学式进行判断.
解答:解:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,
A.X2YZ3中Y的化合价为+4价,不符合,故A错误;
B.X2YZ2中Y的化合价为+2价,不符合,故B错误;
C.XYZ2中Y的化合价为+3价,符合,如NaAlO2,故C正确;
D.XYZ3中Y的化合价为+5价,不符合,故D错误;
故选C.
A.X2YZ3中Y的化合价为+4价,不符合,故A错误;
B.X2YZ2中Y的化合价为+2价,不符合,故B错误;
C.XYZ2中Y的化合价为+3价,符合,如NaAlO2,故C正确;
D.XYZ3中Y的化合价为+5价,不符合,故D错误;
故选C.
点评:本题考查元素推断题,考查角度为根据原子核外电子排布特点推断元素种类,并判断可能的化合物,注意Al的最高化合价为+3价,题目难度不大.

练习册系列答案
相关题目

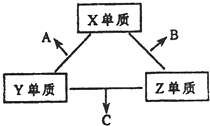 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: