题目内容
【题目】[化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有_______,[Cu(NH3)4]2+的结构简式为_______,阴离子中心原子杂化类型为______。
②氨的沸点远高于膦(PH3),原因是______________。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。
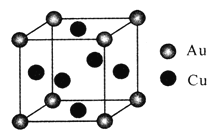
①该合金的化学式为____;
②已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。
【答案】 1 O、S、H 共价键、配位键、离子键 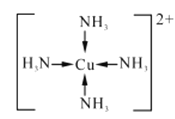 sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au)
sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au) ![]()
【解析】(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,所以有1个未成对电子;同一主族,自上而下元素电负性递减,电负性O>S,H元素与O、S元素化合时,H元素表现正化合价,所以H元素的电负性比O、S元素的小,故电负性O>S>H。
(2)①SO42-、NH3中是以共价键结合形成的,(Cu(NH3)4)2+和SO42-之间结合的是离子键,配合物中Cu2+和(NH3)4(4个氨分子)以配位键结合,故[Cu(NH3)4]SO4中化学键类型有:共价键、离子键、配位键;[Cu(NH3)4]2+中Cu2+和(NH3)4(4个氨分子)以配位键结合,所以结构简式为: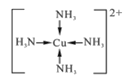 ;中心原子的孤对电子数=
;中心原子的孤对电子数=![]() (a-xb),公式中a为中心原子的价电子数,对于主族元素即为其中心原子的最外层电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,H为1,其余为8-最外层电子数,硫酸根离子中,价层电子对数=σ键个数+
(a-xb),公式中a为中心原子的价电子数,对于主族元素即为其中心原子的最外层电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,H为1,其余为8-最外层电子数,硫酸根离子中,价层电子对数=σ键个数+![]() (a-xb)=4+
(a-xb)=4+![]() (6+2-4×2)=4,所以采取sp3杂化。②氨分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3)。
(6+2-4×2)=4,所以采取sp3杂化。②氨分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3)。
(3)铁和铜属于金属,所以铁铜合金晶体是由金属键形成的晶体,属于金属晶体;因为基态铁原子的价电子排布式为3d64s2,根据洪特规则,原子轨道处于全充满、半充满或全空时,原子处于较低的能量状态,所以失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3。
(4)①根据均摊法计算,晶胞中金原子个数为8×![]() =1,铜原子的个数为6×
=1,铜原子的个数为6×![]() =3,则金和铜的原子个数比为1∶3,该合金的化学式为AuCu3(或Cu3Au)。②合金的密度为dg·cm-3,晶胞质量为:
=3,则金和铜的原子个数比为1∶3,该合金的化学式为AuCu3(或Cu3Au)。②合金的密度为dg·cm-3,晶胞质量为: ![]() g=
g=![]() g,设晶胞边长为a,则晶胞体积为a3,根据密度=质量÷体积,则a=
g,设晶胞边长为a,则晶胞体积为a3,根据密度=质量÷体积,则a=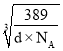 cm,该晶胞结构侧面可用如图表示:
cm,该晶胞结构侧面可用如图表示: ,中间为铜原子,周围是金原子,晶胞边长是
,中间为铜原子,周围是金原子,晶胞边长是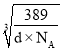 cm,两个金原子间最小间隙为apm(1pm=10-10cm),即a×10-10cm,则金原子半径为:
cm,两个金原子间最小间隙为apm(1pm=10-10cm),即a×10-10cm,则金原子半径为: ![]() (
( -a×10-10)cm,设铜原子半径为r,则在等腰直角三角形中:2(
-a×10-10)cm,设铜原子半径为r,则在等腰直角三角形中:2(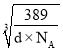 )2=[2r+2×
)2=[2r+2×![]() (
(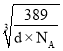 -a×10-10)]2,所以
-a×10-10)]2,所以![]() ×
×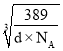 =2r+(
=2r+(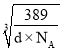 -a×10-10),解得r=(
-a×10-10),解得r=(![]() ×
×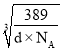 +5a×10-11)cm。
+5a×10-11)cm。

 阅读快车系列答案
阅读快车系列答案