题目内容
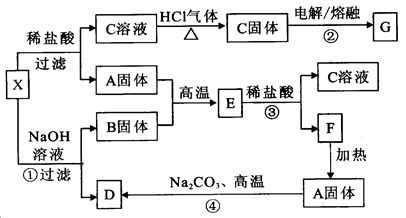
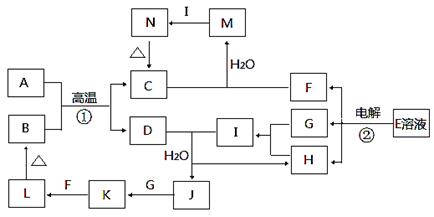
生铁中一般含有化合物B,B只有两种元素组成,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种红棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4同时还生成NaNO2和H2O。各物质之闻的转化关系如下图所示f图中部分生成物没有列出)。

请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________

请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________
⑴二氧化碳的形成过程:
⑵、2Cl-+2H2O
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-4NaOH+3NaNO3+Fe2O3=2Na2FeO4+3NaNO2+2H2O
⑶3︰2;Fe2O3、SO2
⑷取适量的C溶液于试管中,滴加少量KSCN溶液,溶液变红色,说明C溶液中金属阳离子为Fe3+
⑸Fe3C
试题分析:无机推断题得找准突破口,此题的突破口在第③个反应式中,此反应一般涉及的都是电解饱和的食盐水,也就是我们所说的氯碱工业,依题意可知:A为HNO3,D为HNO3,A为H2O,E为NO2,F为CO2,G为NaCl,H为O2,I为Cl2,J为NaOH,K为NaNO3,L为NaClO,M为Fe(OH)3,N为Fe2O3,C为Fe(NO3)3,B为碳和铁的化合物。
(5)A与B的反应为氧化还原反应,在反应过程中得失子是相等的。在此过程中,硝酸是氧化剂,假设生成的二氧化氮为13mol,那么生成的二氧化碳一定是1mol,再假设碳铁化合物中碳的化合价为零价的话,那么铁的化合价也应为零价,依据得失电子相等可知,必须有三个铁来失电子可以,因此,该化合物的化学式为Fe3C.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目

 2Fe2O3+8SO2
2Fe2O3+8SO2
 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑