题目内容
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
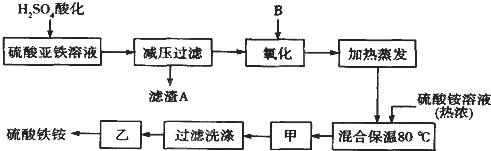
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是 。
(2)下列物质中最适合的氧化剂B是 。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是:甲 。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量 (填试剂的化学式)检验Fe2+是否已全部被氧化;
(5)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为 。
【答案】
(1)增大溶液中SO42-浓度,将Ca2+转化为沉淀,同时抑制Fe2+、 Fe3+水解;
(2)b;(3)冷却结晶;
(4)铁氰化钾(化学式);
(5)Fe2(SO4)3·2(NH4)2SO4·2H2O
【解析】
试题分析:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵。
(1)加入硫酸,可增大溶液中SO42-浓度,将Ca2+转化为沉淀,生成CaSO4,同时抑制Fe2+水解,故答案为:增大溶液中SO42-浓度,将Ca2+转化为沉淀或抑制Fe2+水解;
(2)为避免引入新杂质,应加入过氧化氢为氧化剂,还原产物是水,故答案为:b;
(3)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,故答案为:冷却结晶;
(4)具有亚铁离子可以选用铁氰化钾——K3[Fe(CN)6],若产生蓝色沉淀,则证明存在亚铁离子,故答案为:K3[Fe(CN)6];
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,n(Fe(OH)3)=![]() =0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=
=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=![]() =0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O,故答案为:Fe2(SO4)32(NH4)2SO42H2O。
=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O,故答案为:Fe2(SO4)32(NH4)2SO42H2O。

