题目内容
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题。
(1)实验室中少量的钠通常保存在__________中,在实验室中取用钠的仪器是_______________。
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成________________色的固体,写出该产物与H2O反应的化学方程式:___________________。
(3)将金属钠投入水中,发生反应的离子方程式为______________________。
(4)该同学在实验室欲配制500 ml.0.1 mol/L NaOH溶液。
①配制溶液时肯定不需要如图所示仪器中的______________(填字母),配制上述溶液还需要用到的玻璃仪器是_______________(填仪器名称)。

②根据计算,该同学应用托盘天平称取NaOH的质量为________。
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1 mol/L。下列操作会引起所配浓度偏大的是___________。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
【答案】(1)煤油或石蜡油;镊子(各1分)
(2)淡黄(1分);2Na2O2+2H2O=4NaOH+O2↑(2分)
(3)2Na+2H2O=2Na++2OH-+H2↑(2分)
(4)①AC;烧杯、玻璃棒②2.0 g(2分)③CE(2分)
【解析】
试题分析:(1)钠能够与空气中氧气、水等物质反应,实验室中少量的通常保存在煤油中,在实验室中取用钠的仪器镊子。
(2)钠燃生成黄色的固体过氧化钠,过氧化钠与H2O反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑。
(3)钠投入水中生成氢氧化钠和氢气,2Na+2H2O=2Na++2OH-+H2↑;
(4)配置溶液一定不用烧瓶和分液漏斗,需要的仪器:量筒、玻璃棒、胶头滴管、容量瓶、烧杯等;②配制500 ml.0.1 mol/L NaOH溶液需要NaOH固体质量0.1×0.5×40=2.0 g ;③A.烧杯未进行洗涤,溶质减少,偏低;B.配制前,容量瓶中有少量蒸馏水,溶质不变,无影响;C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容,冷却到室温时,体积减少,浓度偏大;D.往容量瓶转移时,有少量液体溅出,溶质减少,浓度偏低;E.在容量瓶中定容时俯视容量瓶刻度线,造成溶液体积较少,浓度偏大;F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积增大,浓度偏小;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知H2、CO、CH4的燃烧热分别为ΔH1=-285.8 kJ/mol、ΔH2=-283 kJ/mol、ΔH3=-890 kJ/mol。H2O(g)=H2O(l) ΔH4=-44 kJ/mol。回答下列问题:
(1)用CH4替代水煤气作家用燃气的优点是____________________。将煤气灶改为天然气灶时,应适当调_________(填“大”或“小”)空气进气阀门。
(2)合成氨厂一般采用烃(以CH4为例)和水蒸气反应制取原料气H2,发生如下反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
①该反应的ΔH=________________。
②当该反应达到平衡状态时,下列说法一定正确的是__________(填字母)。
A.v(CH4)=v(CO) B.加入催化剂,ΔH不变
C.升高温度,平衡常数K增大 D.CH4与H2O的转化率相等
③T℃时,该反应的初始浓度与起始速率的部分数据如下:
初始浓度/mol·L-1 | 起始速率/mol3·L-3·s-1 | |
c(CH4) | c(H2O) | v |
0.10 | 0.10 | 1.0×10-4 |
0.10 | 0.20 | 4.0×10-4 |
0.30 | 0.20 | 1.2×10-3 |
写出起始速率与初始浓度的关系式[用c(CH4)、c(H2O)及适当的速率常数表示]v=________。
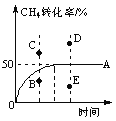
④T℃时,在一个体积可变的恒压密闭容器中,充入0.1 mol CH4、0.1 mol H2O(g)发生反应,起始时容器的体积为1 L。CH4的转化率与反应时间的关系如图中曲线A所示。则T℃时该反应的平衡常数K=____________。若温度与投料方式相同,该反应在容积为1 L的恒容密闭容器中进行,刚达平衡状态的点是__________(选填B、C、D、E)。