题目内容
将3.20g Cu和10.0mol/L的硝酸30.0mL充分反应,还原产物中有NO和NO2。若反应后溶液中有amol 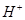 ,则此时溶液中
,则此时溶液中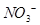 的物质的量为 ( )
的物质的量为 ( )
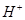 ,则此时溶液中
,则此时溶液中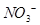 的物质的量为 ( )
的物质的量为 ( )| A.a/2mol | B.2amol | C.0.100amol | D.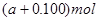 |
D
铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量.
3.2g的物质的量为:3.2g÷64g/mol=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.05mol x
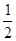 =
=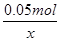 ,解得x=0.1mol,
,解得x=0.1mol,
HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a )mol
故选D.
3.2g的物质的量为:3.2g÷64g/mol=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--C u--2NO3-
1 2
0.05mol x
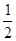 =
=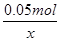 ,解得x=0.1mol,
,解得x=0.1mol,HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a )mol
故选D.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
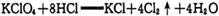 中,每生成4molCl2转移的电子数为8NA
中,每生成4molCl2转移的电子数为8NA