题目内容
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
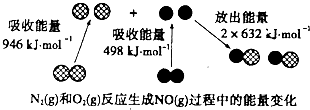
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:
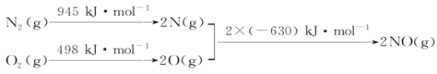
①1 mol O2与1 mol N2的总能量比2 mol NO的总能量________(填“高”或“低”)。
②![]() N2(g)+
N2(g)+![]() O2(g)===NO(g)的ΔH=________。
O2(g)===NO(g)的ΔH=________。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH1。下图是该反应的能量变化图:
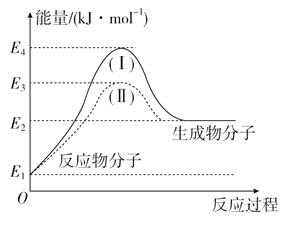
①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH1________(选填“>”“=”或“<”)0。
②图中途径(Ⅱ)的条件是_______________,途径(Ⅰ)的反应热________(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
H2(g)+![]() O2(g)===H2O(g) ΔH2
O2(g)===H2O(g) ΔH2
2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(g) ΔH3
ΔH1、ΔH2、ΔH3三者的关系式为:____________________。
【答案】 低 +91.5 kJ·mol-1 不变 > 使用催化剂 = ΔH3=2×ΔH1+6×ΔH2
【解析】(1)①由N2与O2生成NO的过程可得,断裂1molN![]() N和1molO=O吸收能量:945kJ+498kJ=1443kJ,形成2molNO释放能量:1260kJ,故从总的来看该反应吸收能量,1 mol O2与1 mol N2的总能量比2 mol NO的总能量低;②
N和1molO=O吸收能量:945kJ+498kJ=1443kJ,形成2molNO释放能量:1260kJ,故从总的来看该反应吸收能量,1 mol O2与1 mol N2的总能量比2 mol NO的总能量低;②![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)的ΔH=
O2(g)=NO(g)的ΔH=![]() ×(1443-1260)kJ·mol-1=+91.5 kJ·mol-1;③催化剂能降低反应的活化能,从而加快化学反应速率,但不能改变ΔH,故a值不变。
×(1443-1260)kJ·mol-1=+91.5 kJ·mol-1;③催化剂能降低反应的活化能,从而加快化学反应速率,但不能改变ΔH,故a值不变。
(2)①通过图中信息可得,反应物的总能量低于生成物的总能量,所以反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH1>0;②图中途径(Ⅱ)降低了反应的活化能,故使用了催化剂;催化剂能降低反应的活化能,但不能改变ΔH,故途径(Ⅰ)的反应热=途径(Ⅱ)的反应热;③由已知,根据盖斯定律可得:ΔH3 =2×ΔH1+6×ΔH。