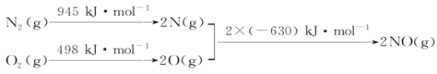题目内容
【题目】在恒温、体积为2 L的密闭容器中加入1 mol CO2和3 mol H2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。
CH3OH(g)+H2O(g) ΔH<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
B.v正(CO2)=v逆(H2O)
C.容器内混合气体密度保持不变
D.3 mol HH键断裂同时断裂3 mol HO键
【答案】B
【解析】A.容器中CO2、H2、CH3OH、H2O的物质的量之比也可能为1:3:1:1,该反应可能达到平衡状态,也可能没有达到平衡状态,与反应初始浓度和转化率有关,A错误;B.v正(CO2)=v逆(H2O),方向相反,化学反应速率之比与计量数成正比,能判断平衡状态,B正确;C.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)反应中,前后气体质量不变,固定容积,体积不变,故密度不是变量,不能判断化学平衡状态,C错误;D.3 mol HH键断裂同时,应该断裂2 mol HO键,才能说明化学达到平衡状态,当3 mol HH键断裂同时,断裂3 mol HO键时不能据此判断化学平衡状态,D错误;故选B。
CH3OH(g)+H2O(g)反应中,前后气体质量不变,固定容积,体积不变,故密度不是变量,不能判断化学平衡状态,C错误;D.3 mol HH键断裂同时,应该断裂2 mol HO键,才能说明化学达到平衡状态,当3 mol HH键断裂同时,断裂3 mol HO键时不能据此判断化学平衡状态,D错误;故选B。

练习册系列答案
相关题目