题目内容
8.下列分离方法不正确的是( )| A. | 用过滤的方法除去食盐水中的泥沙 | B. | 用蒸馏的方法将自来水制成蒸馏水 | ||
| C. | 用四氯化碳萃取碘水中的碘 | D. | 用分液漏斗分离酒精和水的混合物 |
分析 A.泥沙不溶于水;
B.自来水中水的沸点较低;
C.碘不易溶于水,易溶于四氯化碳;
D.酒精和水的混合物不分层.
解答 解:A.泥沙不溶于水,则用过滤的方法除去食盐水中的泥沙,故A正确;
B.自来水中水的沸点较低,则利用蒸馏的方法制蒸馏水,故B正确;
C.碘不易溶于水,易溶于四氯化碳,则可用四氯化碳萃取碘水中的碘,故C正确;
D.酒精和水的混合物不分层,不能利用分液漏斗分离,应选蒸馏法,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列电子式书写正确的是( )
| A. | HCl  | B. | HClO  | C. | H2O2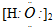 | D. | Na2O2 |
19.NH3是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG或ADG.

(2)某学生用如图装置对NH3与NaClO的反应进行实验探究:
资料:氨和次氯酸钠溶液反应能生成肼.肼常温下是无色液体,沸点:113℃,与水混溶,它的水溶液是一种二元弱碱.
①向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
②进一步实验确认了A中生成了N2H4.写出A中反应的化学方程式(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为0.25NA.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为ACG或ADG.

(2)某学生用如图装置对NH3与NaClO的反应进行实验探究:
| 操作 | 现象 |
 | 液面上方出现白雾 |
①向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
②进一步实验确认了A中生成了N2H4.写出A中反应的化学方程式(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为0.25NA.
16.在密闭容器中有可逆反应:nA(g)+mB(g)?pC(g);处于平衡状态(已知n+m>p,正反应为吸热反应),则下列说法正确的是:( )
①升温,c(B):c(C)的比值变小
②降温时体系内混合气体平均分子量变小
③加入B,A的转化率减小
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,体系内混合气体平均分子量一定增大
⑥若A的反应速率为vA,则B的反应速率vB=$\frac{n}{m}$vA.
①升温,c(B):c(C)的比值变小
②降温时体系内混合气体平均分子量变小
③加入B,A的转化率减小
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,体系内混合气体平均分子量一定增大
⑥若A的反应速率为vA,则B的反应速率vB=$\frac{n}{m}$vA.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③⑥ | D. | ③④⑤⑥ |
13.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | CaO+H2O═Ca(OH)2 | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | H2CO3═H2O+CO2↑ |
20.用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A. | 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| B. | 标准状况下,22.4LSO3含有NA个分子 | |
| C. | 标准状况下,11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA | |
| D. | 60g石英晶体中含有的Si-O键数目为2NA |
18.一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是( )
| A. | 2A+B?2C | B. | A+B?2C | C. | 2A+B?C | D. | 2A+B?4C |
