题目内容
【题目】下表为元素周期表的一部分,请回答有关问题:
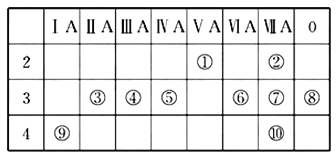
(1)⑤的元素符号是______;
(2)②的离子结构示意图__________________;
(3)表中最活泼的金属是______(填写元素符号);
(4)表中元素②③④的原子半径由大到小排列____________(用元素符号表示);
(5)表中能形成两性氢氧化物的元素是______ ,分别写出该元素的氢氧化物与⑨最高价氧化物对应水化物反应的离子方程式: __________________________________;
(6)比较⑦、⑩单质氧化性的强弱:___________(用化学式表示),请设计一个实验证明你的结论__________________________________ 。
【答案】 Si 略 K Mg>Al>F Al Al(OH)3+OH- =AlO2-+2H2O Cl2>Br2 在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色),可得氧化性Cl2>Br2(其他合理答案也可)
【解析】根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br元素;
(1)⑤是Si元素;
(2)F-的结构示意图为![]() ;
;
(3)元素周期表中,最活泼的金属元素位于周期表左下角,根据给予周期表结构知,最活泼的金属元素是K;
(4)Mg、Al、Cl为同周期的主族元素,核电荷数越大原子半径越小,则原子半径由大到小排列Mg>Al>Cl;F、Cl同主族,核电荷数越大原子半径越大,则原子半径由大到小排列Cl>F,F、Mg、Al原子半径由大到小排列为Mg>Al>F;
(5)Al元素能形成两性氢氧化物,⑨最高价氧化物的水化物反应是KOH,Al(OH)3和强碱反应都生成盐和水,其离子反应方程式为Al(OH)3+OH- =AlO2-+2H2O ;
(6)Cl、Br为同主族元素,核电荷数大非金属强,即氧化性Cl2>Br2,如在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色),即可得氧化性Cl2>Br2。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。请你根据所学知识回答下列问题:
(1)上述反应中 是氧化剂,该反应中氧化产物与还原产物的物质量之比为 。
(2)把氯气通入紫色石蕊溶液中,可以观察到的现象是: 。
(3)实验室配制好2.0 mol·L-1的NaOH溶液,需要这种溶液 mL才能与2.24 L氯气(标准状况)恰好完全反应。
(4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式并用双线桥法表示出电子转移情况: 。
(5)现需490 mL 2.0 mol·L-1NaOH溶液:
①所需称量的氢氧化钠固体的质量是 。
②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、 。
③在配制溶液的过程中,下列操作可能造成结果偏高的是 。
A.定容时俯视 |
B.容量瓶不干燥,含有少量蒸馏水 |
C.溶解所用烧杯未洗涤 |
D.NaOH溶解后,未冷却即进行实验 |