题目内容
下列有关阿伏加德罗常数(NA)的说法正确的有( )
分析:A、根据标准状况下水不是气体进行判断;
B、根据重水的物质的量计算出含有的质子数;
C、根据亚硫酸属于弱电解质,溶液中部分电离分析;
D、根据铜和硫酸的物质的量判断过量,根据不足量进行计算.
B、根据重水的物质的量计算出含有的质子数;
C、根据亚硫酸属于弱电解质,溶液中部分电离分析;
D、根据铜和硫酸的物质的量判断过量,根据不足量进行计算.
解答:解:A、在标况下,水不是气体,无法计算出22.4L水的物质的量,故A错误;
B、20g重水的物质的量为1mol,含有10mol质子,含有的质子数目为10NA,故B正确;
C、100mL 0.1mol/L的H2SO3溶液中含有0.01mol亚硫酸,由于亚硫酸属于弱电解质,溶液中部分电离,所以溶液中的离子的物质的量小于0.03mol,含有的离子数小于0.03NA,故C错误;
D、3.2g铜的物质的量为0.05mol,完全反应需要消耗0.1mol硫酸;10.0g 98%的H2SO4中含有9.8g浓硫酸,物质的量为0.1mol,由于随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以0.1mol浓硫酸与铜反应生成的二氧化硫的物质的量小于0.05mol,故D错误;
故选:B.
B、20g重水的物质的量为1mol,含有10mol质子,含有的质子数目为10NA,故B正确;
C、100mL 0.1mol/L的H2SO3溶液中含有0.01mol亚硫酸,由于亚硫酸属于弱电解质,溶液中部分电离,所以溶液中的离子的物质的量小于0.03mol,含有的离子数小于0.03NA,故C错误;
D、3.2g铜的物质的量为0.05mol,完全反应需要消耗0.1mol硫酸;10.0g 98%的H2SO4中含有9.8g浓硫酸,物质的量为0.1mol,由于随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以0.1mol浓硫酸与铜反应生成的二氧化硫的物质的量小于0.05mol,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗常数,注意稀硫酸与铜不反应,注意重水中的摩尔质量及含有的质子数,本题难度不大.

练习册系列答案
相关题目
 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是
 总数为0.9
总数为0.9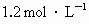
 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关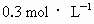 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是
 总数为0.9
总数为0.9



