题目内容
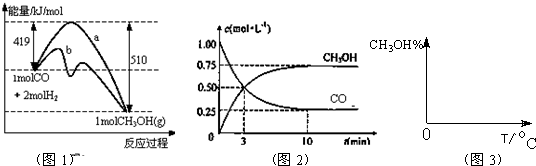
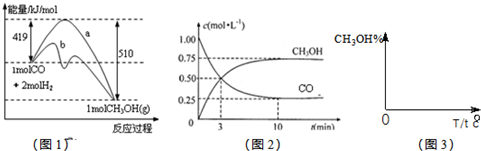
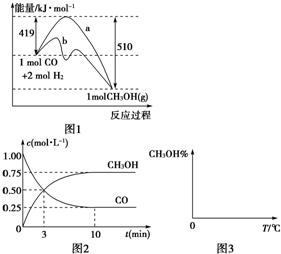 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.请回答下列问题:
(1)在“图1”中,曲线
(2)下列说法正确的是
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡,v(H2)=
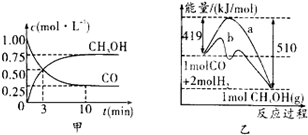
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2).
(5)已知CH3OH(g)+
| 3 | 2 |
(6)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.写出用Co3+除去甲醇的离子方程式
分析:(1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)A.利用转化的CO和平衡时CO的量来分析;
B.增加CO浓度,会促进氢气的转化;
C.该反应为反应前后压强不等的反应;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动.
(3)由图2计算用CO表示的反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率,利用各物质平衡的浓度来计算化学平衡常数;
(4)根据温度和压强对该反应的影响来分析;
(5)根据盖斯定律来解答;
(6)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+.
(2)A.利用转化的CO和平衡时CO的量来分析;
B.增加CO浓度,会促进氢气的转化;
C.该反应为反应前后压强不等的反应;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动.
(3)由图2计算用CO表示的反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率,利用各物质平衡的浓度来计算化学平衡常数;
(4)根据温度和压强对该反应的影响来分析;
(5)根据盖斯定律来解答;
(6)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+.
解答:解:(1)由图可知,曲线b降低了反应所需的活化能,则b使用了催化剂,又该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应,故答案为:b;放热;
(2)A.由图2可知生成0.75mol/LCH3OH,则反应了0.75mol/LCO,平衡时有0.25mol/LCO,即CO的起始物质的量为(0.75mol/l+0.25mol/L)×2L=2mol,故A错误;
B.增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B错误;
C.该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时
会增大,故D错误.
故答案为:C;
(3)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为
=0.075mol?L-1?min-1,
因反应速率之比等于化学计量数之比,则v(H2)=0.075mol?L-1?min-1×2=0.15mol?L-1?min-1,
CO(g)+2H2(g)?CH3OH(g)
开始1mol/L 2mol/L 0
转化0.75mol/L 1.5mol/L 0.75mol/L
平衡0.25mol/L 0.5mol/L 0.75mol/L
则化学平衡常数K=
=12 L2?mol-2,
故答案为:0.15mol?L-1?min-1;12 L2?mol-2;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
 ,故答案为:
,故答案为: ;
;
(5)CH3OH(g)+
O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol ①
H2O(l)=H2O(g)△H=+44kJ/mol ②
①-②×2得:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol;
(6)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
(2)A.由图2可知生成0.75mol/LCH3OH,则反应了0.75mol/LCO,平衡时有0.25mol/LCO,即CO的起始物质的量为(0.75mol/l+0.25mol/L)×2L=2mol,故A错误;
B.增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B错误;
C.该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时
| n(CH3OH) |
| n(CO) |
故答案为:C;
(3)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为
| 0.75mol/L |
| 10min |
因反应速率之比等于化学计量数之比,则v(H2)=0.075mol?L-1?min-1×2=0.15mol?L-1?min-1,
CO(g)+2H2(g)?CH3OH(g)
开始1mol/L 2mol/L 0
转化0.75mol/L 1.5mol/L 0.75mol/L
平衡0.25mol/L 0.5mol/L 0.75mol/L
则化学平衡常数K=
| 0.75mol/L |
| 0.25mol/L×(0.5mol/L ) 2 |
故答案为:0.15mol?L-1?min-1;12 L2?mol-2;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
 ,故答案为:
,故答案为: ;
;(5)CH3OH(g)+
| 3 |
| 2 |
H2O(l)=H2O(g)△H=+44kJ/mol ②
①-②×2得:CH3OH(g)+
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(6)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
点评:本题考查反应速率的计算、化学平衡有关计算、热化学方程式书写、氧化还原反应等,难度中等,注意对知识的理解与掌握,是对学生能力的考查.

练习册系列答案
相关题目