题目内容
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
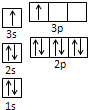
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______。
②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。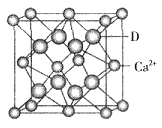
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。

(1)①能量最低原理(2分) ②sp(2分) 直线(2分)
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
②Al-3e-+4OH-=AlO2-+2H2O(2分) ③8;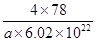 (3分)
(3分)
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
②Al-3e-+4OH-=AlO2-+2H2O(2分) ③8;
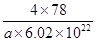 (3分)
(3分)试题分析:(1)A的第三电离能比第二电离能大很多,这说明A很难失去3个电子,因此A应该是第ⅡA族元素。同样B的第三电离能比第二电离能大很多,即B也很难失去3个电子,因此B是第ⅡA族元素。 同主族自上而下金属性逐渐增强,第一电离能逐渐减小,则A是Be,B是Mg。
①根据核外电子排布规律可知,只有排满了3s才能排3p,所以该示意图违背了能量最低原理。
②BeCl2分子中Be含有的孤电子对数是
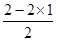 =0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
=0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,因此C是铝。D是周期表中电负性最大的元素,则D是F。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E是Cu。
①根据核外电子排布规律可知铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
②以C单质、镁、NaOH溶液可以构成原电池,由于铝能与氢氧化钠溶液反应,而镁不能,因此负极是铝,镁是正极,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O。
③根据晶胞结构可知,钙离子周围与钙离子最近的氟离子有8个(每个面被2个立方体共用),则Ca2+离子的配位数为8。晶胞中含有该离子的个数是8×
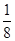 +6×
+6× =4,氟离子是8个,因此
=4,氟离子是8个,因此 ×6.02×1023=4,解得V=
×6.02×1023=4,解得V=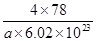 cm3。
cm3。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目