题目内容
用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
分析:反应的方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
| ||
| △ |
解答:解:30g乙酸的物质的量为
=0.5mol,46g乙醇的物质的量为
=1mol,
反应的方程式为CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
1mol 1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故选A.
| 30g |
| 60g/mol |
| 46g |
| 46g/mol |
反应的方程式为CH3COOH+CH3CH2OH
| ||
| △ |
CH3COOH+CH3CH2OH
| ||
| △ |
1mol 1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故选A.
点评:本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.

练习册系列答案
相关题目
用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
| A、29.5 g | B、44 g | C、74.8 g | D、88 g |
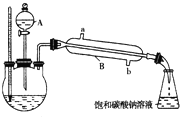 已知如表所示数据:
已知如表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g?cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | - | 338.0 | 1.84 |
①在三颈烧瓶中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合液80mL.
②按如图所示连接好装置(装置气密性良好,加热以及夹持装置省略),用小火均匀加热装有混合液的三颈烧瓶5~10min.
③边加热,边从仪器A向三颈烧瓶中滴加乙醇.
④待锥形瓶收集到一定量产物后停止加热,用力振荡锥形瓶,然后静置待分层.
⑤分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)仪器A使用前必须进行的操作是
(2)仪器B的名称是
(3)乙醇与乙酸反应的化学方程式是
(4)实验完成后,锥形瓶里液面上有透明的不溶于水的油状液体,若分离油状液体混合物,需要用到的主要玻璃仪器是
(5)用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是
A.44g B. 29.3g C.74.8g D.88g.
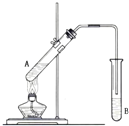 在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.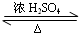 CH3COOC2H5+H2O
CH3COOC2H5+H2O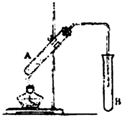 在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,如图连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,如图连接好装置进行实验,以制取乙酸乙酯.