题目内容
【题目】实验室制取下列气体时,只能用排水法收集的是( )
A. H2 B. NO C. CO2 D. NO2
【答案】B
【解析】分析:气体的收集方法有排水法、排空气法,只能用排水法收集,说明选项中的气体能够与空气中的氧气反应,且该气体不与水反应或易溶于水等,结合气体的性质进行解答。
详解:A.氢气能够用排水法和排空气法收集,A错误;
B.一氧化氮能够与空气中的氧气反应,不能使用排空气法收集,所以只能使用排水法水解一氧化氮,B正确;
C.二氧化碳溶于水,不能用排水法收集,通常采用排空气法收集二氧化碳,C错误;
D.二氧化氮能够与水反应,不能使用排水法收集,只能使用排空气法,D错误;答案选B。

 考前必练系列答案
考前必练系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
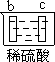
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
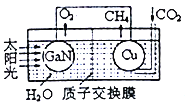
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
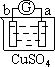
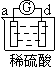
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c