题目内容
【题目】硫代硫酸钠晶体(Na2S2O35H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如下图:
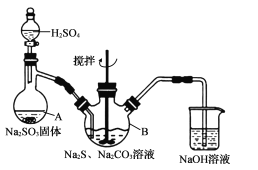
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是____,Na2S的电子式为____。
(2)三颈烧瓶B中制取Na2S203反应的总化学方程式为_______________
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
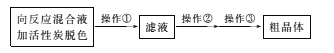
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是____;操作②是____;操作③是抽滤、洗涤、干燥。
(4)测定Na2S203.5H2O纯度取6.00 g产品,配制成100 mL溶液。取10. 00 mL溶液,以淀粉溶液为指示剂,用浓度0. 0500 mol/L的标准溶液进行滴定,反应原理为2S2O32-+I2![]() S4O62-+2I-,相关数据记录如下表所示。
S4O62-+2I-,相关数据记录如下表所示。
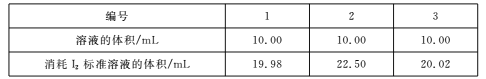
Na2S2035H20的纯度为____%(保留1位小数)。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________________________________
【答案】蒸馏烧瓶 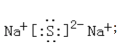 4SO2+2Na2S+Na2CO3=3Na2S203+CO2 为了防止晶体在漏斗中大量析出导致产率降低 蒸发浓缩,冷却结晶 82.7% S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+
4SO2+2Na2S+Na2CO3=3Na2S203+CO2 为了防止晶体在漏斗中大量析出导致产率降低 蒸发浓缩,冷却结晶 82.7% S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+
【解析】
(l)仪器A是蒸馏烧瓶;Na2S为离子化合物,根据组成写出Na2S的电子式;
(2)二氧化硫、硫化钠、碳酸钠混合反应生成Na2S203和CO2,据此写出反应方程式;
(3) 趁热过滤,防止溶液中Na2S2O35H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,据此进行分析;
(4) 根据实验数据计算出消耗标准液的体积,注意数据的选用;根据2S2O32--- I2关系可知n(Na2S2O35H2O)=2n(I2),然后根据题给数据计算出产品纯度。
(l)仪器A的名称是蒸馏烧瓶;Na2S为离子化合物,Na2S的电子式为:
综上所述,本题答案是:蒸馏烧瓶;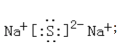
(2)二氧化硫、硫化钠、碳酸钠混合反应生成Na2S203和CO2,反应的总化学方程式为:
4SO2+2Na2S+Na2CO3=3Na2S203+CO2;综上所述,本题答案是:4SO2+2Na2S+Na2CO3=3Na2S203+CO2。
(3) 从上述生成物混合液中获得较高产率Na2S2O35H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O35H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶;
因此,本题正确答案是:为了防止晶体在漏斗中大量析出导致产率降低;蒸发浓缩,冷却结晶。
(4) 第二组实验数据相差较大,舍去,故消耗标准液的体积为(19.98+20.02)/2=20.00mL,根据2S2O32--- I2关系可知n(Na2S2O35H2O)=2n(I2),故产品纯度为: [20×10-3×0.05×2×(100/10)×248]/6×100%=82.7%;综上所述,本题答案是:82.7%。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+;综上所述,本题答案是:S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+。

 阅读快车系列答案
阅读快车系列答案