题目内容
工业制硫酸中,SO2的催化氧化是一个可逆反应:2SO2+O2
2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).
(1)请填写下表空白:
(2)比较法是一种重要的化学学习方法.请用比较法归纳上表中的反应速率与化学方程式中的计量数之间的关系:
| ||
(1)请填写下表空白:
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 |
3.0 | 1.5 | 0 |
| 10min后的浓度 /mol?L-1 |
2.0 2.0 |
1.0 1.0 |
1.0 1.0 |
| 平均反应速率 /mol?L-1min-1 |
0.1 0.1 |
0.05 0.05 |
0.1 |
各物质(包括反应物和生成物)的反应速率与化学计量数成正比
各物质(包括反应物和生成物)的反应速率与化学计量数成正比
.分析:(1)由图表可知,10min内SO3的平均反应速率,SO2和O2的起始浓度,根据SO3的平均反应速率,利用△c=v△t计算出SO3的浓度变化量,再根据方程式,计算出SO2和O2的浓度变化量;利用v=
计算出SO2和O2的均反应速率.
(2)根据(1)的计算结果分析反应速率与化学方程式中的计量数之间的关系.
| △c |
| △t |
(2)根据(1)的计算结果分析反应速率与化学方程式中的计量数之间的关系.
解答:解:(1)10min内SO3的平均反应速率为0.1mol?L-1min-1,所以,△(SO3)=0.1mol?L-1min-1×10min=1mol?L-1,
根据2SO2+O2
2SO3可知,
△c(SO2)=△c(SO3)=1mol?L-1,
△c(O2)=
△c(SO3)=
×1mol?L-1=0.5mol?L-1,
10min后SO2的浓度为3mol/L-1mol/L=2mol/L
10min后O2的浓度为1.5mol/L-0.5mol/L=1mol/L
所以,v(SO2)=
=
=0.1mol?L-1min-1;
v(O2)=
=
=0.05mol?L-1min-1.
故答案为:
10min后的浓度:2.0;1.0;1.0;
平均反应速率:0.1mol?L-1min-1;0.05;
(2)由(1)数据可得出:各物质(包括反应物和生成物)的反应速率与化学计量数成正比
故答案为:各物质(包括反应物和生成物)的反应速率与化学计量数成正比
根据2SO2+O2
| ||
△c(SO2)=△c(SO3)=1mol?L-1,
△c(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
10min后SO2的浓度为3mol/L-1mol/L=2mol/L
10min后O2的浓度为1.5mol/L-0.5mol/L=1mol/L
所以,v(SO2)=
| △c(SO2) |
| △t |
| 1mol/L |
| 10min |
v(O2)=
| △c(O2) |
| △t |
| 0.5mol/L |
| 10min |
故答案为:
10min后的浓度:2.0;1.0;1.0;
平均反应速率:0.1mol?L-1min-1;0.05;
(2)由(1)数据可得出:各物质(包括反应物和生成物)的反应速率与化学计量数成正比
故答案为:各物质(包括反应物和生成物)的反应速率与化学计量数成正比
点评:本题考查了反应速率的有关计算,难度不大,以基础为主,注意计算反应速率的两种常用方法:定义法、化学计量法.

练习册系列答案
相关题目
工业制硫酸中的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下列有关的叙述不正确的是( )
| A、使用催化剂是为了加快反应速率,提高生产效率 | B、在上述条件下,SO2、O2、SO3将共存于反应体系之中 | C、当生成O2的速率与生成SO3的速率相等时达到了平衡 | D、为了提高SO2的转化率,可适当地提高O2的浓度 |
工业制硫酸中,SO2的催化氧化是一个可逆反应:2SO2+O2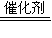 2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).
2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).
(1)请填写下表空白:
(2)比较法是一种重要的化学学习方法.请用比较法归纳上表中的反应速率与化学方程式中的计量数之间的关系: .
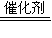 2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).
2SO3,即该反应达到一定限度后,就会在反应物和生成物之间建立一种动态平衡(即化学平衡).(1)请填写下表空白:
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 | 3.0 | 1.5 | |
| 10min后的浓度 /mol?L-1 | |||
| 平均反应速率 /mol?L-1min-1 | 0.1 |