题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如下:
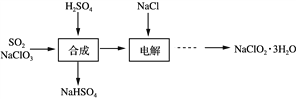
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为_____________________________。
(2) “电解”步骤阳极会生成一种气体,其化学式为____________ 。
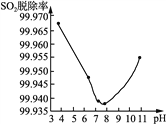
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为_____________________________________。
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达________试剂纯度。(写出计算过程)
已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]()
【答案】 2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2 Cl2 碱性条件下OH-吸收SO2 n(Na2S2O3)=2.00mol·L-1×22×10-3L=4.4×10-2mol
NaClO2 …………………………4Na2S2O3
1 4
n(NaClO2) 4.4×10-2mol
n(NaClO2)=1.1×10-2mol
ω(NaClO2)=![]() ×100%=99.55%
×100%=99.55%
产品达到化学纯度
【解析】本题分析:本题主要考查氧化还原反应。
(1) 反应中NaClO3被还原为ClO2,SO2被氧化为![]() ,其反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2。
,其反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2。
(2) 在阳极氯离子被氧化为氯气,其化学式为Cl2。
(3) SO2 为酸性气体,碱性条件下OH-吸收SO2。
(4) n(Na2S2O3)=2.00mol·L-1×22.00×10-3L=4.4×10-2mol
NaClO2 ~ 4Na2S2O3
1 4
n(NaClO2) 4.4×10-2mol
n(NaClO2)=1.1×10-2mol
ω(NaClO2)=![]() ×100%=99.55%
×100%=99.55%
产品达到化学试剂纯度。