题目内容
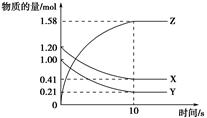
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
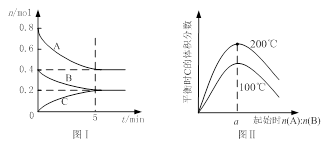
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是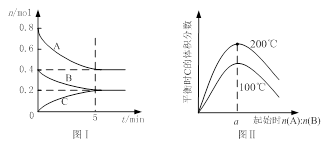
A.200℃时,反应从开始到平衡的平均速率v(B)=" 0." 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g)
 zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
AD
|
 C。只有当两种反应物按照方程式的计量数的关系加入时生成物C达到平衡时含量才会最高。故a=2。错误。C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,v(正)=v(逆)。错误。D.由图Ⅰ可知在200℃时,若加入0.8mold A和0.4mol B,达到平衡时A的含量为0.5。若向容器中充入2 mol A 和1 mol B,即增大了反应物的浓度,同时容器内气体的压强增大。根据平衡移动原理:增大压强,化学平衡向正反应方向移动。所以达到平衡时,A 的体积分数小于0.5。正确。考点:
C。只有当两种反应物按照方程式的计量数的关系加入时生成物C达到平衡时含量才会最高。故a=2。错误。C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,v(正)=v(逆)。错误。D.由图Ⅰ可知在200℃时,若加入0.8mold A和0.4mol B,达到平衡时A的含量为0.5。若向容器中充入2 mol A 和1 mol B,即增大了反应物的浓度,同时容器内气体的压强增大。根据平衡移动原理:增大压强,化学平衡向正反应方向移动。所以达到平衡时,A 的体积分数小于0.5。正确。考点:
练习册系列答案
相关题目
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白: 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )