题目内容
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。(1)K= 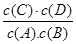 <
<
(2)0.022 0.09 80% 不变
(3)C
(4)2 .5
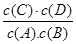 <
< (2)0.022 0.09 80% 不变
(3)C
(4)2 .5
试题分析:(1)可逆反应达到平衡状态时各生成物浓度的幂指数的乘积与各反应物浓度幂指数的乘积的比。该反应的化学平衡常数K=
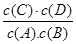 。因为升高温度,化学平衡常数减小,说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。所以该反应的正反应为放热反应。所以△H<0.(2)v(A)=0.003 mol·L-1·s-1,△c(A)= v(A)×△t=0.003 mol·L-1·s-1×6s=0.018mol/L则6s时c(A)=(0.20mol÷5 L)-0.018mol/L=0.022mol/L.C的物质的量0.018mol/L×5 L= 0.09mol。因为在830℃时化学平衡常数K=1.0.假设在反应的过程中A消耗的物质的量为x 则达到平衡时各物质的物质的量分别是A:(0.20-x)mol;B:(0.80-x)mol;C:xmol;D:xmol.由于各物质的方程式前边的系数都为1,所以达到平衡时的物质的量的比等于浓度的比。X2÷[(0.20-x)×(0.80-x)]=1.0.解得x=0.16.所以A的转化率为(0.16÷0.20)×100%=80%。如果这时向该密闭容器中再充入1 mol氩气,因为容器的容积不变。A的浓度不变,所以平衡不发生移动。故平衡时A的转化率也不变。(3)A.因为该反应是个反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,容器内气体的压强都不会发生改变。错误。B.由于在反应前后气体的体积不变,反应遵循质量守恒定律,质量也不变,因此任何时刻,无论反应是否达到平衡,气体的密度都不改变。错误。C.若反应未达到平衡,则 c(A)就会发生改变。现在c(A)不随时间改变,说明反应达到了平衡状态。正确。D.在方程式中,C和D都是生成物,系数相同,所以在任何时间段内单位时间里生成C和D的物质的量总是相等,因此不能以此为标准判断反应是否达到平衡状态。错误。故正确的选项为C。(4)在1200℃时A(g)+B(g)
。因为升高温度,化学平衡常数减小,说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。所以该反应的正反应为放热反应。所以△H<0.(2)v(A)=0.003 mol·L-1·s-1,△c(A)= v(A)×△t=0.003 mol·L-1·s-1×6s=0.018mol/L则6s时c(A)=(0.20mol÷5 L)-0.018mol/L=0.022mol/L.C的物质的量0.018mol/L×5 L= 0.09mol。因为在830℃时化学平衡常数K=1.0.假设在反应的过程中A消耗的物质的量为x 则达到平衡时各物质的物质的量分别是A:(0.20-x)mol;B:(0.80-x)mol;C:xmol;D:xmol.由于各物质的方程式前边的系数都为1,所以达到平衡时的物质的量的比等于浓度的比。X2÷[(0.20-x)×(0.80-x)]=1.0.解得x=0.16.所以A的转化率为(0.16÷0.20)×100%=80%。如果这时向该密闭容器中再充入1 mol氩气,因为容器的容积不变。A的浓度不变,所以平衡不发生移动。故平衡时A的转化率也不变。(3)A.因为该反应是个反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,容器内气体的压强都不会发生改变。错误。B.由于在反应前后气体的体积不变,反应遵循质量守恒定律,质量也不变,因此任何时刻,无论反应是否达到平衡,气体的密度都不改变。错误。C.若反应未达到平衡,则 c(A)就会发生改变。现在c(A)不随时间改变,说明反应达到了平衡状态。正确。D.在方程式中,C和D都是生成物,系数相同,所以在任何时间段内单位时间里生成C和D的物质的量总是相等,因此不能以此为标准判断反应是否达到平衡状态。错误。故正确的选项为C。(4)在1200℃时A(g)+B(g) C(g)+D(g)的平衡常数
C(g)+D(g)的平衡常数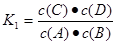 反应C(g)+D(g)
反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为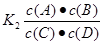 ;可见K1、K2互为倒数。因为此时K1=0.4,所以K2=1÷0.4=2 .5。
;可见K1、K2互为倒数。因为此时K1=0.4,所以K2=1÷0.4=2 .5。
练习册系列答案
相关题目
 HOI(aq) △H2
HOI(aq) △H2
 pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是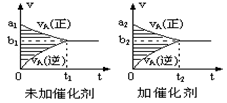
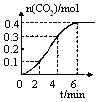
 CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是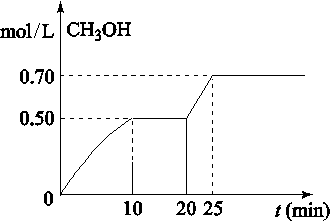
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是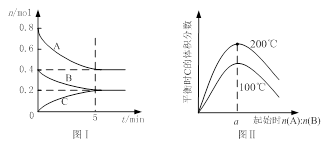
 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( ) cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )
cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )