题目内容
(8分)(1) 用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
①、计算机芯片的主要成分是 ,(填名称)
②、光导纤维的主要成分是 ;(填名称)
(2)硅是地壳中含量很高的元素,其单质和化合物在新型和传统非金属材料中用途广泛
①、写出工业上用碳单质还原二氧化硅制备硅的化学反应方程式;
_________________________________________________________,
②、用方程式表示为什么不能用有玻璃塞的试剂瓶存放碱性溶液
。
1)①单晶硅(或硅单质) ②二氧化硅
(2))① 2C + SiO2 Si + 2CO↑ ② SiO2 + 2NaOH=Na2SiO3 + 2H2O (各2分)
Si + 2CO↑ ② SiO2 + 2NaOH=Na2SiO3 + 2H2O (各2分)
解析

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是 ;A与E形成的化合物的电子式是 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是 。
(4)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是 。
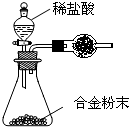
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)

①实验需要测定三个物理量:合金的质量m以及a和b。
a是 ;
b是 。
②合金中A元素的质量分数是 (用含m、a、b的式子表示)。
 A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示: